灯盏花乙素治疗高脂血症的潜在分子生物学机制分析
作者:admin 来源:未知 日期:2021-01-19 08:35人气:
刘思莹 任蓁 凌爽 牛文颖 王雨晴 郭婉琴 肖洪彬
黑龙江中医药大学附属第一医院 黑龙江中医药大学 黑龙江中医药大学佳木斯学院
摘 要:
目的 通过网络药理学和分子对接探讨灯盏花乙素治疗高脂血症的潜在分子生物学机制。方法 通过Pharmmapper平台寻找灯盏花乙素药效团作用靶点基因,通过Genecard和OMIM数据库筛选高脂血症相关靶点基因,构建化合物-靶点基因-疾病网络,获取共同作用靶点基因。将共同作用靶点基因上传至String平台,建立蛋白相互作用(PPI)网络,筛选核心靶点基因。利用DAVID数据库对核心靶点蛋白进行GO生物过程及KEGG通路富集分析。通过Auto Dock Vina软件对灯盏花乙素与核心靶点蛋白进行分子对接验证。结果 灯盏花乙素潜在作用靶点基因366个,高脂血症相关靶点基因1 280个,筛选出共有靶点基因39个,PPI网络中degree前6位的靶点基因有过氧化氢酶(CAT)、血红素加氧酶1(HMOX1)、髓过氧化物酶(MPO)、前列腺素-内过氧化物合酶2(PTGS2)、血管紧张素Ⅰ转换酶(ACE)、C反应蛋白(CRP),为核心靶点基因。主要参与的生物过程包括氧化应激反应、氧气水平的反应、抗生素反应、缺氧的反应、营养水平的反应、细胞排毒反应等;涉及的信号通路主要有PPAR信号通路、脂肪的消化吸收、花生四烯酸代谢、TNF信号通路、AMPK信号通路、Fox O信号通路、胆固醇代谢、调节脂肪细胞中的脂肪分解等。灯盏花乙素与CAT、MPO、PTGS2、ACE、HMXO1、CRP的活性位点均能够形成2个以上的氢键,结合能分别为-11.4、-10.8、-10.6、-9.8、-9.5、-8.9 k J/mol。结论 灯盏花乙素可能通过CAT、HMOX-1、MPO、PTGS2、ACE、CRP等靶点调控PPAR信号通路、脂肪酸氧化和吸收、胆固醇代谢等多条途径治疗高脂血症。
关键词:
灯盏花乙素 高脂血症 生物信息学分析 网络药理学 分子对接
Analysis of potential molecular biological mechanism of scutellarin in treatment of hyperlipidemia
LIU Siying REN Zhen LING Shuang NIU Wenying WANG Yuqing GUO Wanqin XIAO Hongbin
The First Affiliated Hospital of Heilongjiang University of Chinese Medicine;
Abstract:
Objective To investigate the potential molecular biological mechanism of scutellarin against hyperlipidemia based on network pharmacology and molecular docking. Methods The possible targets of scutellarin were searched in Pharmmapper platform. The Genecard and OMIM databases were used to screen the targets related to hyperlipidemia( HLP). We constructed a " compound-target-disease" network to obtain common target genes,uploaded the co-action target genes to the String platform,established PPI network,and screened out the core target genes. Enrichment analysis of core target proteins in GO biological process and KEGG pathway was conducted by DAVID database. Auto Dock Vina software was used to verify the molecular docking of scutellarin and core target protein.Results There were 366 potential target genes for scutellarin and 1 280 hyperlipidemia-related target genes,and meanwhile,39 common target genes were screened out. The first 6 degree target genes in the PPI network, including catalase( CAT), heme oxygenase 1( HMOX1),myeloperoxidase( MPO),prostaglandin-endoperoxidase 2( PTGS2),angiotensin I converting enzyme( ACE),and C-reactive protein( CRP),were the core target genes. The main involved biological processes included oxidative stress response,oxygen level response,antibiotic response,hypoxia response,nutrient level response,cell detoxification response,etc.; the involved signal pathways mainly included PPAR signaling pathway,fat digestion and absorption,arachidonic acid metabolism,TNF signaling pathway,AMPK signaling pathway,Fox O signaling pathway,cholesterol metabolism,and regulation of lipolysis in adipocytes,etc. Scutellarin could form more than 2 hydrogen bonds with the active sites of CAT,MPO,PTGS2,ACE,HMXO1,and CRP,and the binding energies were -11.4,-10.8,-10.6,-9.8,-9.5,and-8.9 k J/mol,respectively.Conclusion Scutellarin may mainly regulate PPAR,fatty acid oxidation and absorption,cholesterol metabolism and other pathways to treat hyperlipidemia through targets such as CAT,HMOX-1,MPO,PTGS2,ACE,CRP,and other targets.
Keyword:
scutellarin; hyperlipidemia; bioinformatics analysis; network pharmacology; molecular docking;
高脂血症是动脉粥样硬化、心血管疾病、糖尿病等疾病发生发展的重要因素,纠正高脂血症对于预防心脑血管疾病具有重要意义。高脂血症的发生机制复杂,包括脂蛋白的吸收、抑制合成和促进排泄等多种因素的相互作用,使用单一靶向药物治疗效果不佳。中药中多组分的降脂作用可能参与脂质代谢调控的各个步骤,对正常脂质合成和代谢可能具有重要意义。目前许多中药都被用于调节血脂,治疗心脑血管疾病[1]。因此,开发中药多靶点、多途径治疗对防治高脂血症具有重要意义。灯盏花素是从灯盏细辛中提取的一种黄酮类有效成分,其主要成分为灯盏花乙素。灯盏花乙素具有较强的生物学活性,亦是临床上常用的单体化合物成分,已被制成多种剂型用于治疗心脑血管疾病,如动脉粥样硬化、冠心病、脑供血不足、心绞痛等[2,3]。临床实践中发现,灯盏花乙素可调节血脂、降低血液黏度、提高机体抗缺氧能力,从而延缓心脑血管疾病及其慢性并发症的发生和发展[4,5]。2020年3~5月,本研究尝试通过网络药理学分析,探索灯盏花乙素治疗高脂血症潜在的分子机制,为其临床应用及高脂血症相关疾病的研究提供一定的理论依据。
1 材料与方法
1.1 数据库及软件
有机小分子生物活性数据库,Protein Data Bank ,Pharmmapper平台服务器,Venny2.1软件,String 11.0软件,Uniprot数据库,Gene Cards数据库和OMIM数据库。
1.2 化合物-靶点基因-疾病网络的构建
通过Pubchem数据库检索灯盏花乙素(Scutellarin)的3D化合物化学结构,下载保存为mol2格式并上传到Pharmmapper平台服务器,获取药效团文件,通过手工检索、联合uniprot数据库和使用Perl脚本,寻找药效团对应靶点,物种限定为“Homo sapiens”。最后将获取的靶点合并去重,即为灯盏花乙素潜在作用靶点。以“Hyperlipidemia”为关键词,在Gene Cards和OMIM数据库中筛选出高脂血症相关靶基因,得到疾病相关的靶点基因。将灯盏花乙素化合物潜在靶点基因和疾病靶点基因同时导入Cytoscape3.7.2软件,构建化合物-靶点基因-疾病网络,最后运用Network Analyzer功能分析其拓扑学属性。
1.3 灯盏花乙素作用靶点蛋白相互作用(PPI)网络的构建
通过Venny2.1软件,提交疾病和药物靶点,获取两者共同作用靶点。将筛选得到的共有靶点基因上传至String平台,建立PPI网络,设置蛋白种类为“Homo sapiens”,隐藏网络中孤立的蛋白,其他参数保持默认设置,导出PPI网络图,分析统计靶点蛋白关联频次。将String平台筛选出来的具有相互作用功能的基因导入Cytoscape3.7.2软件,通过拓扑网络中cyto Hubba插件中最大派系中心度分析并筛选出灯盏花乙素治疗高脂血症的核心靶点基因。
1.4核心靶点基因的GO生物过程及KEGG通路富集分析
将上述方法筛选出的PPI网络核心靶点基因利用R cluster Profiler包进行基因本体GO生物过程注释和KEGG通路富集分析,以P<0.05且从小到大排序,选取前20个GO生物过程注释及KEGG通路。利用R ggplot2包绘制相应图形。
1.5 灯盏花乙素与核心靶点蛋白的分子对接
分子对接技术是验证分子和靶点作用关系的有效途径,将灯盏花素活性成分作为配体、PPI网络中degree前6位的靶点作为受体,进行分子对接。在Pub Chem CID下载灯盏花乙素活性成分的三维结构,在PDB数据库下载核心靶点蛋白结构,用小分子结构绘制软件Chem Bio Drew对其进行常规预处理,然后用Pymol软件删除多余的蛋白结构,去掉水分子以及其他无关配体,导入Auto Dock Vina1.1.2软件选择半柔性对接模式,对接参数为默认。其中,结合能小于0表明配体分子能够和受体蛋白自发结合,结合能小于-5.0 k J/mol,表明其结合性好,结合能越小则对接越好[6]。
2 结果
2.1 化合物-靶点基因-疾病网络构建情况
共获得化合物靶点基因366个,疾病靶点基因1 280个,构建化合物-靶点基因-疾病网络,获得疾病基因与化合物靶点基因映射,筛选出共同作用靶点基因39个,确定为灯盏花乙素治疗高脂血症的的靶点基因。包括E3-SUMO蛋白转移酶NSE2(NSMCE2)、NLR家族含3的Pyrin域(NLRP3)、脂肪酸合酶(FAS)、脑源性神经营养因子(BDNF)、磷脂转运ATP酶(ABCA1)、δ-氨基乙酰丙酸脱水酶(ALAD)、C反应蛋白(CRP)、细胞色素P450 7A1(CYP7A1)、羧肽酶B2(CPB2)、胰腺三酰甘油脂肪酶(PNLIP)、膜伯胺氧化酶(AOC3)、Krueppel样因子2(KLF2)、髓过氧化物酶(MPO)、前列腺素内过氧化物合酶2(PTGS2)、G1/S特异性细胞周期蛋白D1(CCND1)、DNA连接酶4(LIG4)、3磷酸甘油脱氢酶1样蛋白(GPD1L)、基质金属蛋白酶1(MMP1)、膜联蛋白A5(ANXA5)、线粒体解偶联蛋白2(UCP2)、血管紧张素转换酶(ACE)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)、血红素加氧酶1(HMOX1)、中链特异性酰基辅酶A脱氢酶(ACADM)、糖原磷酸化酶(PYGL)、E3泛素蛋白连接酶(TRIM21)、基质金属蛋白酶14(MMP14)、肌红蛋白(MB)、膜相关鸟苷酸激酶(MAGI2)、1,6-双磷酸果糖酶1(FBP1)、过氧化氢酶(CAT)、核受体共激活剂2(NCOA2)、谷胱甘肽过氧化物酶3(GPX3)、前列腺素内过氧化物合酶1(PTGS1)、脂肪酸结合蛋白(FABP2)、雄激素受体(AR)、肌酸激酶M型(CKM)、血管内皮生长因子B(VEGFB)、丝氨酸蛋白酶1(PRSS1)。
2.2 PPI网络及其核心靶点基因
将筛选的39个共有靶点蛋白上传至String平台,建立PPI网络。该网络共有37个节点,98条相互作用关系,平均度值为5.38。PPI网络中degree最高的前6个基因为CAT、CRP、HMOX1、PTGS2、MPO、ACE。
2.3 核心靶点基因GO生物过程及KEGG通路富集分析结果
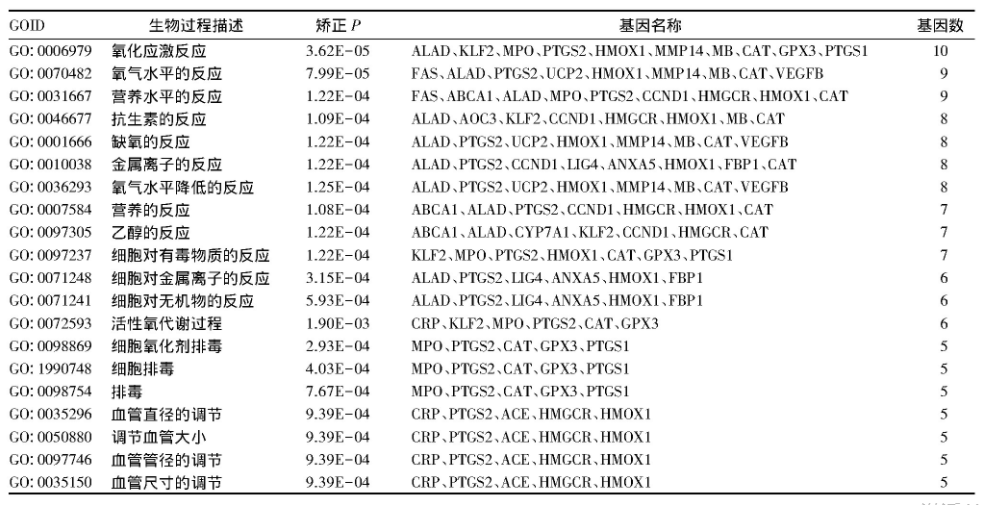
共有靶点基因主要参与的生物过程包括氧化应激反应、氧气水平的反应、抗生素反应、缺氧的反应、营养水平的反应、细胞排毒反应等(表1);涉及的信号通路主要有PPAR信号通路、脂肪的消化吸收、花生四烯酸代谢、TNF信号通路、AMPK信号通路、Fox O信号通路、胆固醇代谢、调节脂肪细胞中的脂肪分解等(表2)。
表1 核心靶点基因的GO生物过程分析结果

2.4 灯盏花乙素与靶蛋白分子对接结果
灯盏花乙素与degree较高的6个核心靶点蛋白的活性位点均能够形成2个以上的氢键。灯盏花乙素与CAT、MPO、PTGS2、ACE、HMXO1、CRP的结合能分别为-11.4、-10.8、-10.6、-9.8、-9.5、-8.9 k J/mol,其中灯盏花乙素与CAT蛋白的结合能最低,结合能力最强。灯盏花乙素能与CAT的活性位点ARG 112、ARG 72、SER 114和TYR 358形成氢键,这也是促使其结合到活性位点的主要作用力。
3 讨论
高脂血症的发生机制非常复杂,多种生物过程和多种信号通路参与了胆固醇的代谢过程。中药被认为能够针对炎症、氧化应激、能量代谢、内质网应激、凋亡等多个环节发挥治疗高脂血症的作用。灯盏花乙素是一种黄酮苷类化合物,可通过抗氧化活性来防治非酒精性脂肪肝[7]、动脉粥样硬化[8]、缺血再灌注损伤[9]、胰岛素抵抗[10]等相关代谢性疾病。本研究通过网络药理学建立药物化合物-靶点基因-疾病网络和核心靶点网络,发现CAT、HOXM1、CRP、MPO、PTGS2、ACE是灯盏花素治疗高脂血症的核心靶点;PPI网络分析表明,这些蛋白均处于网络的核心位置,至少与7个蛋白存在相互作用关系。CAT和HOXM1具有抗氧化、调节炎症反应、促进微循环等作用[11,12]。CRP是由肝细胞合成和分泌的球蛋白,受炎症因子调节和诱导,是评价炎症性疾病的指标之一,并参与血栓形成和动脉粥样硬化的病理过程,是冠心病、脑卒中等疾病的危险因素之一[13,14]。MPO被认为是炎症反应的标志物之一,在生理条件下MPO参与机体的固有免疫,过量释放的MPO可诱导机体发生氧化应激反应,大量超氧化物和氧化物形成,造成机体炎症部位损伤。有研究表明,MPO通过多种途径参与动脉粥样硬化发生和发展的全过程[15]。PTGS2是体内前列腺素合成的关键酶,在正常组织中很少表达,在炎症组织中呈高表达,在炎症反应中发挥重要作用[16,17]。ACE是一种含锌离子的金属蛋白酶,能够催化血管紧张素Ⅰ向血管紧张素Ⅱ转化,使血管收缩而增加血压。通过抑制ACE使血管紧张素Ⅱ形成减少和缓激肽代谢减少,导致动脉和静脉系统扩张、动脉血压降低。目前ACE2研究比较广泛,它与心血管疾病、动脉粥样硬化和2型糖尿病等关系密切。ACE主要在动脉粥样硬化斑块的内皮细胞、平滑肌细胞和巨噬细胞中有大量表达,这也提示ACE有可能是抗动脉粥样硬化的重要因素之一[18]。上述结果表明,灯盏花乙素治疗高脂血症是通过多靶点、多途径来实现的。
表2 核心靶点基因的KEGG通路富集分析结果


从GO富集分析结果可知,差异基因主要参与氧化应激反应、缺氧的反应、抗生素反应、营养水平的反应、细胞排毒反应、细胞氧化剂反应等生物过程。KEEG分析结果显示,核心靶点基因参与的信号通路主要是PPAR信号通路,其次是脂肪的消化吸收、AMPK信号通路、Fox O信号通路、胆固醇代谢、调节脂肪分解等。PPAR参与调节肝脏炎症和脂质代谢过程,促进脂肪细胞分化,提高血糖摄取,在动脉粥样硬化的形成过程中起着重要的作用[19,20]。有研究报道,灯盏花乙素可通过PPARγ/PGC-1α/Nrf2途径作用于下游靶点CAT、HMOX1,调控其抗氧化应激信号通路,减少脂质过氧化作用,降低高脂喂养大鼠的血脂水平[21]。高脂状态下,血脂升高,自由基生成增加,大量的自由基破坏了机体氧化平衡,导致脂蛋白发生氧化修饰,增强氧化应激和内毒素形成,从而造成内皮损伤。灯盏花素可能通过干预氧化应激损伤、TNF信号通路和炎症反应相关信号通路等途径协同发挥治疗高脂血症的作用。我们采用分子对接技术进一步验证分子和靶点作用的关系,结果显示,灯盏花乙素与degree较高的6个核心靶点蛋白的活性位点均能够形成2个以上的氢键,结合能力较强,提示灯盏花乙素的作用机制与调控抗氧化因子和炎症因子有关。
综上所述,本研究以灯盏花乙素为研究对象,通过网络药理学结合分子对接方法分析了其治疗高脂血症的核心靶点及通路,并初步验证了灯盏花素与核心靶点的相互作用关系和结合力,揭示了灯盏花素治疗高脂血症具有多靶点、多通路的作用机制。
参考文献
[1]马希英,李军.高脂血症从瘀论治四法[J].吉林中医药,2004,24(1):15-16.
[2]Wang C,Li Y,Gao S,et al.Breviscapine injection improves the therapeutic effect of western medicine on angina pectoris patients[J].PLo S One,2015,10(6):e0129969.
[3]Wang C,Li Y,Gao S,et al.Breviscapine injection improves the therapeutic effect of western medicine on angina pectoris patients[J].PLo S One,2015,10(6):e0129969.
[3]Guo C,Zhu YR,Weng Y,et al.Therapeutic time window and underlying therapeutic mechanism of breviscapine injection against cerebral ischemia/reperfusion injury in rats[J].Ethnopharmacol,2014,151(1):660-666.
[4]张明艳,范淑娟,李利平,等.灯盏花注射液抗新生鼠缺氧缺血性脑损伤的作用及对Bcl-2、Bax蛋白表达的影响[J].中国应用生理学杂志,2011,27(2):196-200.
[5]Gao J,Chen G,He H,et al.Therapeutic effects of breviscapine in cardiovascular diseases:a review[J].Front Pharmacol,2017(8):289.
[6]庄莉,翟园园,姚卫峰,等.基于网络药理学的二至丸对肾脏保护作用的机制研究[J].药学学报,2019,54(5):877-885.
[7]Chen Q,Liu M,Yu H,et al.Scutellaria baicalensis regulates FFAmetabolism to ameliorate NAFLD through the AMPK-mediated SREBP signaling pathway[J].Nat Med,2018,72(3):655-666.
[8]张小超,沈志强,杨仁华,等.灯盏乙素对大鼠动脉粥样硬化的防治作用[J].中药药理与临床,2017,33(2):59-63.
[9]毛哲哲,陈奎利,冯强,等.灯盏花素对大鼠肺缺血再灌注后氧化应激的影响及机制研究[J].中南药学,2017,15(1):61-64.
[10]Luan H,Huo Z,Zhao Z,et al.Scutellarin,a modulator of m TOR,attenuates hepatic insulin resistance by regulating hepatocyte lipid metabolism via SREBP-1c suppression[J].Phytother Res,2020,34(6):1455-1466.
[11]于德玲,王昌留.过氧化氢酶的研究进展[J].中国组织化学与细胞化学杂志,2016,25(2):189-194.
[12]张晓华,杨慧,张晓倩.血红素加氧酶-1对疾病进展及预后的影响[J].中华实用诊断与治疗杂志,2018,32(4):404-407.
[13]李广平.C反应蛋白与冠状动脉疾病关系的研究进展[J].天津医药,2009,37(11):985-987.
[14]Zhang X,Huang WJ,Yu ZG.Relationship between the hypersensitive c-reactive protein(hs-CRP) level and the prognosis of acute brainstem infarction[J].Cell Biochem Biophys,2015,72 (1):107-110.
[15]梅琳琳.PCI术对冠心病患者外周血MPO水平的影响[J].中国民康医学,2016,28(9):50-51.
[16]Wang L,Jiang N,Lin QR,et al.Cyclooxygenase-2 (COX-2) polymorphism rs689466 may contribute to the increased susceptibility to post-traumatic osteomyelitis in Chinese population[J].Infect Dis,2017,49(11-12):817-823.
[17]Ferrer MD,Busquets-Cortes C,Capo X,et al.Cyclooxygenase-2inhibitors as a therapeutic target in inflammatory diseases[J].Curr Med Chem,2019,26(18):3225-3241.
[18]张月辉,于庆涛,董波.ACE2与心血管疾病的关系研究进展[J].济宁医学院学报,2012,1(3):168-172.
[19]Gross B,Pawlak M,Lefebvre P,et al.PPARs in obesity-induced T2DM,dyslipidaemia and NAFLD[J].Nat Rev Endocrinol,2017,13(1):36-49.
[20]Hihi AK,Michalik L,Wahli W.PPARs:transcriptional effectors of fatty acids and their derivatives[J].Cell Mol Life Sci Cmls,2002,59(5):790-798.
[21]Zhang X,Ji R,Sun H,et al.Scutellarin ameliorates nonalcoholic fatty liver disease through the PPARγ/PGC-1α-Nrf2 pathway[J].Ree Radic Res,2018,52(2):198-211.


