非小细胞肺癌脑膜转移的个体化治疗分析
作者:admin 来源:未知 日期:2021-02-03 08:40人气:
摘 要:
目的:对非小细胞肺癌(non-small cell lung cancer,NSCLC)脑膜转移(leptomeningeal metastasis,LM)患者的个体化治疗行探索性分析。方法:选择于2018年12月至2020年3月福建省肿瘤医院确诊收治的NSCLC合并LM患者18例,收集患者临床诊治资料及生存随访。结果:18例患者中表皮生长因子受体(epidermal growth factor receptor,EGFR)突变14例,间变性淋巴瘤激酶(anaplastic lymphomakinase,ALK)突变1例,ROS原癌基因1(ROSproto-oncogene1ROS1)突变1例,野生型2例。合并基因突变的LM患者接受以酪氨酸激酶抑制剂(tyrosine-kinase inhibitor,TKI)为基础的靶向治疗联合,或不联合全身及局部综合治疗;共14例患者接受鞘内注射(intrathecal chemotherapy,ITC)培美曲塞治疗。根据神经肿瘤评估标准(responseassessmentinneuro-oncology,RANO)进行疗效评价,其中12例患者好转,2例稳定,4例进展。结论:NSCLC合并LM需要个性化综合治疗,对存在基因突变的患者采用TKI靶向治疗仍为基石,鞘内注射培美曲塞可能成为一种治疗选择。
关键词:
非小细胞肺癌 脑膜转移 靶向治疗 鞘内注射治疗 培美曲塞
Analysis of individualized therapy for leptomeningeal metastasis of non-small cell lung cancer
MIAO Qian ZHENG Xiaobin ZHANG Longfeng WU Biao JIANG Kan LIN Gen
Department of Thoracic Oncology, Fujian Provincial Cancer Hospital, Affiliated Cancer Hospital of Fujian Medical University;
Abstract:
Objective: To conduct an exploratory analysis of individualized treatment of leptomeningeal metastasis(LM) in patients with non-small cell lung cancer(NSCLC). Methods: Eighteen NSCLC patients with LM admitted to Fujian Provincial Cancer Hospital from December 2018 to March 2020 were selected. Clinical and treatment data and survival follow-up of patients with LM were collected. Results: Fourteen patients harbored epidermal growth factor receptor(EGFR) mutations, 1 anaplastic lymphoma kinase(ALK) fusion, 1 proto-oncogene 1(ROS1) fusion, and 2 wild-type. LM patients with genetic mutations received tyrosine kinase inhibitor(TKI)-based targeted therapy with or without combined systemic and local comprehensive treatment. A total of 14 patients received intrathecal chemotherapy(ITC) with pemetrexed. According to the response assessment in neuro-oncology(RANO), 12 of 18 patients were evaluated as responding, 2 were stable, and 4 were progressive. Conclusion: Individualized comprehensive treatment can prolong the survival of patients of LM. The targeted therapy of patients harbored genetic mutations is still the cornerstone, and ITC of pemetrexed may become a treatment option.
Keyword:
non-small cell lung cancer; leptomeningeal metastasis; targeted therapy; intrathecal chemotherapy; pemetrexed;
肺癌是全球发病率及病死率最高的恶性肿瘤,3%~5%的非小细胞肺癌(non-small cell lung c an cer,NSCLC)患者在初诊或治疗后出现脑膜转移(leptomeningeal metastasis,LM)[1],随着NSCLC靶向治疗的发展和不同治疗策略的优化组合,N S CL C生存期大大延长,颅外病变可获得长期控制,但是由于血脑屏障(blood-brain barrier,BBB)的特殊结构以及对于药物的渗透限制,软脑膜下空间成为肿瘤细胞的避难所。目前NSCLC患者合并LM的诊断率并不高,且治疗缺乏规范统一的指南。LM预后极差,即便给予综合治疗,LM患者生存仅从1~3个月提升至3~11个月[1-3]。本研究回顾性分析确诊LM的NSCLC患者的临床特征、治疗经过及生存随访,旨在为NSCLC的LM患者个体化治疗提供思路。
1 对象与方法
1.1 对象
选择2018年12月至2020年3月福建省肿瘤医院收治的NSCLC伴LM的患者。纳入标准:组织病理学明确诊断为肺腺癌的患者,初诊时均行组织行实时聚合酶链反应(real-time polymerase chain reaction,RT-PCR),检测表皮生长因子受体(epidermal growth factor receptor,EGFR)突变;行免疫组织化学(D5F3IHC),检测间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变;采用荧光原位杂交(fluorescence i n s i t u hy b r i d i z at i o n,F I S H),检测R O S原癌基因1(ROS proto-oncogene 1,ROS1)的突变状态。因症状或头颅磁共振(magnetic resonance imaging,MRI)影像学怀疑脑膜转移的患者,脑脊液(cerebrospinal fluid,CSF)细胞学病理找到肿瘤细胞或可疑癌细胞并行全身或局部治疗。排除标准:水肿带明显的脑实质转移患者;CSF细胞学找到非典型细胞或无癌细胞、无基因突变状态的患者。
1.2 方法
收集分析LM患者诊断前的一般临床资料和分子病理诊断;LM确诊前后全身或局部治疗方案;根据神经肿瘤评估标准(response assessment i n n eu ro-o n col og y,R A N O)对确诊L M后治疗方案进行疗效评价,评价分为好转、稳定及进展[4]。神经系统无进展生存(neurological progression-free sur v ival,NPFS)被定义为从疾病确诊时间到L M进展或死亡的时间。生存时间(overall survival,OS)为从疾病确诊时间到死亡或最后随访。确诊LM前行头颅增强MRI和/或全脊髓增强MRI,治疗后每6周复查头颅增强MRI和/或全脊髓增强MRI。根据美国国家癌症研究所不良事件通用术语标准4.03版对不良事件(adverse events,AEs)进行评估,超过3级及以上不良事件被定义为严重AEs。随访最后日期为2020年4月31日。
在确诊LM后,患者接受全身治疗和/或局部治疗,其中全身治疗包括静脉化疗、抗血管治疗、酪氨酸激酶抑制剂(tyrosine-kinase inhibitor,T K I)靶向治疗、免疫治疗。在静脉化疗中,常见化疗方案为培美曲塞联合卡铂(pemetrexed and carboplatin,AC)、紫杉醇(Pemetrexed,P)、吉西他滨(Gemcitabine,G)、长春瑞滨(Vinorelbine,N V B)。抗血管治疗药物包括贝伐珠单抗(B ev ac i z u mab,B)或安罗替尼(A n l o t i n i b)。T K I靶向治疗药物包括EGFR的2代TKI阿法替尼(Afatinib)以及3代TKI奥希替尼(Osimertinib);ALK/ROS1的新一代TKI劳拉替尼(Loratinib)。免疫治疗药物为帕博利珠单抗(Pembrolizumab)。局部治疗主要为鞘内注射治疗(intrathecal chemotherapy,ITC)及全脑放射治疗(whole brain radiation therapy,WBRT)。鞘注药物为培美曲塞,用法为将10 mg培美曲塞溶解于生理盐水10 m L经腰穿或Ommaya囊泵给予鞘注,每周1次,共4~6周,每次鞘注后给予地塞米松5 mg预防化学性脑膜炎,治疗同时给予补充叶酸及维生素B12。
1.3 统计学处理
使用SPSS 22.0统计学软件进行数据分析,并使用描述性统计总结患者的人口统计学信息,生存分析采用Kaplan-Meier乘积法。患者均有明确的随访数据,无脱落。
2 结果
2.1 临床特征
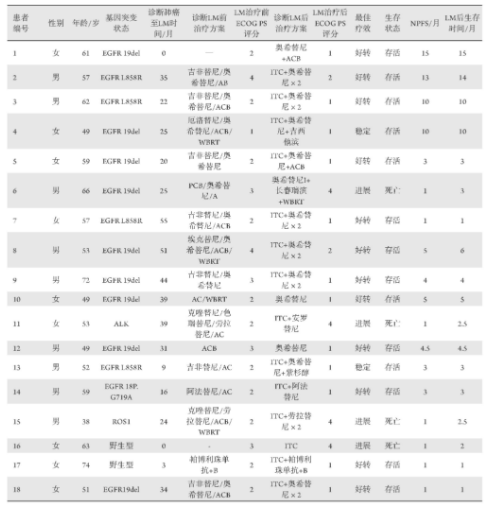
共3 1例患者存在L M相关症状,1例患者影像学诊断考虑L M,其中有2 2例患者接受腰穿检查,最终1 8例患者确诊L M (表1),均为肺腺癌患者,男女各9例(5 0.0%),年龄3 8~7 2 (中位数57)岁。2例患者初诊即存在L M(11.1%),1 6例患者为治疗后出现L M (8 8.9%)。1 4例患者合并E G F R突变,其中1 9 d e l 9例(5 0.0%)、L 8 5 8 R 4例(2 2.2%)、非经典突变EG F R 1 8 P.G 7 1 9 A1例(5.6%);1例患者合并A L K融合(5.6%);1例患者合并ROS1融合(5.6%);2例患者为野生型(1 1.0%)。1 7例患者的美国东部肿瘤协作组体力状态评分(Eastern Cooperative Oncology Group Performance Status,E C O G P S)>1,仅P 4患者E C O G P S 1分。初诊肺癌至发展为L M的时间为0~5 5 (中位数2 5)个月。
表1 一般临床特征
2.2 治疗
1 8例患者在确诊L M后均接受全身和/或局部治疗。在2例野生型患者中,1例(P16)为初诊仅行1周期ITC后拒绝全身治疗,1例(P17)在帕博利珠单抗联合B抗血管的治疗基础上联合ITC。5例EG F R突变患者既往未使用过3代T K I药物,1例初诊患者(P1)行AC化疗联合B抗血管联合奥希替尼;1例(P 1 3)既往使用过1代T K I联合A C化疗,在L M进展后未检测到T790M,行奥希替尼联合P化疗联合ITC;1例非经典突变患者(P14)继续2代TKI基础上联合ITC;2例(P10/12)既往仅行化疗从未使用过TKI治疗患者单用奥希替尼靶向治疗。11例患者为1代及3代TKI治疗进展后(包括EGFR/ALK/ROS1),6例(P2/3/7/8/9/18)行奥希替尼加倍剂量联合ITC;1例(P5)行奥希替尼联合ITC基础上联合ACB化疗;1例(P4)行奥希替尼常规量联合ITC联合G化疗;1例(P6)拒绝ITC,接受奥希替尼联合口服NVB同时接受WBRT;1例(P11)ALK患者接受安罗替尼联合ITC;1例ROS1患者(P15)接受劳拉替尼加倍剂量联合ITC(表1)。
2.3 短期疗效及安全性
截至最后随访日期,4例患者死亡,14例患者存活,8例患者达到NPFS,中位随访时间为4个月(95%CI:2.3~5.7个月)。根据RANO评价临床疗效:12例患者好转(66.7%),2例稳定(11.1%),4例进展(22.2%)。截至随访日期,4例进展患者均已死亡,P6患者因急性症状接受WBRT,症状及脑部影像学一度有好转,但因快速广泛的脊膜转移导致病情恶化而死亡(图1)。ALK(P11)及ROS1(P15)患者各1例,均因包括LM在内的全身疾病快速进展死亡。P16患者野生型初诊LM,行1周期ITC治疗,拒绝全身治疗,确诊后仅2个月死亡。截至末次随访日期,存活的14例患者并未出现肺部原发灶及远处转移灶的进展,确诊LM治疗后中位NPFS时间为13.0个月(95%CI:2.5~23.5个月),OS数据不成熟。LM治疗后患者AEs主要表现为化疗及靶向治疗的常见AEs,在全身治疗联合鞘注治疗的患者中并未观察到额外的严重AEs发生,1例患者鞘注后出现1级体位性低血压,补液后恢复;1例患者出现2级头痛,止痛处理后恢复。
图1 头颅磁共振图像,T1w+c增强

3 讨论
L M的尽早诊断对于抢救性治疗至关重要,诊断金标准为CSF找到肿瘤细胞,但在实际临床工作中很少行腰穿检查。因为患者往往临床表现凶险,ECOG PS评分高,所以对于积极操作及进一步治疗存在顾虑。本研究中LM患者综合性治疗后临床控制率并不低,但LM患者中既有初诊患者,又有多程治疗后患者,有基因突变患者,也有野生型患者,不同类型患者治疗需进行个体化选择。研究[3]显示:在EGFR突变的患者中,LM的发生率可高达9.4%,远远大于非突变患者。本研究中EGFR突变患者比例高达77.8%,无论经典突变与非经典突变均可出现LM。另外,ALK及ROS1患者也可见LM的发生。
目前多以使用RANO系统评价LM疗效[4],需要满足三大因素的综合分析,包括标准化的神经系统检查评分、CSF细胞学检查或流式细胞学检测以及影像学表现。但对此系统也存在一定争议,包括神经系统检查评分无法区分LM的相关症状来自于全身疾病的进展还是脑实质转移的影响,亦或是治疗后的不良反应[5],实际操作存在困难。CSF的细胞学敏感性低,有一定的假阴性率,且CSF的转阴是否代表生存期的延长并无定论。本研究中12例患者治疗后复查了CSF,仅2例患者CSF转阴,由于生存期不成熟,CSF转阴是否代表更好的预后尚不明确。研究[6]显示:20%~30%的LM患者影像学表现正常,软脑膜转移为不可测量病灶,因此以影像学表现难以进行标准评估。本研究中,综合治疗后,L M患者可获得7 7.8%的疾病控制率,N P FS达到1 3个月,OS并不成熟。随着随访时间延长,NPFS与OS或许为非常接近的数值。
对E G F R/A L K未使用过T K I治疗的患者来说,奥希替尼[7]和阿来替尼[8-9]单药对于颅内病灶及LM均有良好疗效,是首选的治疗药物。但是对于已接受多线EGFR-TKI靶向治疗后出现LM的患者来说,全身EGFR-TKI治疗仍然重要,如Ya n g等[10]及Clarke等[11]的研究显示:奥希替尼加倍剂量(160 mg/d)或厄洛替尼(Erlotinib)脉冲疗法(2 0 0 0 mg/周)可以增加药物血脑屏障的穿透率,对LM患者具有一定的疗效。本研究中,11例EGFR突变患者在1代及3代TKI治疗后出现LM,其中6例患者接受了奥希替尼160 mg的加倍剂量治疗,显示出良好的耐受性,配合其他治疗下均有好转。劳拉替尼作为抑制ALK/ROS1通道的新一代TKI最大限度减少BBB泵出机制中P-糖蛋白介导的药物外流,克服了已知的ALK耐药机制,但对LM的疗效仍然需要临床研究进一步证实[12-13]。ROS1合并LM的数据有限,治疗方案可参考ALK患者。对于合并基因突变的LM患者来说,无论在初诊还是多程治疗后,继续维持TKI的全身治疗都极为重要。对于无基因突变LM患者,全身治疗往往选择AC方案联合B抗血管的治疗模式,免疫联合化疗或免疫联合抗血管也是目前新兴治疗模式,但需要进一步临床研究。总体而言,无突变的LM患者预后更差。
I T C是L M的局部治疗选择之一[14],I TC的优势在于药物可以直接渗透BBB并最大化暴露在C S F中。目前鞘注药物使用最多的甲氨蝶呤、阿糖胞苷和塞替派[1,15],但这些药物主要用于治疗血液系统肿瘤,对于肺癌并不敏感。目前有研究[16-19]尝试了在肺癌LM患者中鞘注拓扑替康、阿糖胞苷脂质体及依托泊苷,但都是小样本临床试验或个案报道。Sun等[20]建立了大鼠鞘内培美曲塞(intrathecal pemetrexed,IP)模型,在大鼠中以1 mg/k g的培美曲塞进行鞘注后检测大鼠CS F中培美曲塞药物浓度,发现其可以在CSF中维持较高浓度及较长时间,并未观察到AE的发生。Pan等[21]的对LM肺癌患者鞘注培美曲塞I期临床试验显示:1 0 m g培美曲塞鞘内给药与维生素补充剂配合使用,每周1~2次,结果表现出了可控的毒性和良好的疗效。本研究中,14例患者接受了培美曲塞ITC治疗,其中10例患者在LM确诊前静脉化疗使用过培美曲塞方案,仍有6例患者表现有效,2例稳定,2例进展。A LK及ROS1患者虽然接受了ITC,但是未表现出疗效,培美曲塞ITC是否仅对不同突变患者存在不同疗效需要进一步的研究加以证实。另外,培美曲塞鞘注最佳剂量、频率、治疗周期仍需要更多的临床试验寻找答案,鞘内注射化疗药物仍需要大样本的临床数据来确认其疗效及安全性。
L M患者的短生存期让W B R T的意义并不明确。一项回顾性研究[22]显示无生存获益,急需控制症状的患者仍然可以考虑。对于EGFR突变患者出现脑转移时尽早介入WBRT是否能够延缓LM的发展目前尚不明确,有待进一步研究。
不同基因状态、治疗经历以及ECOG PS状态的患者给予的治疗模式不尽相同,需要个体化治疗。LM的ECOG PS评分下降往往因LM引起,及时积极的综合治疗对于患者生存期的延长,生活质量的提升是有意义的。本研究为回顾性研究,入组患者诊断LM前一般状态及经济状态较好,并且剔除了合并脑水肿患者,不能代表广泛LM患者。
综上,NSCLC患者LM发生率逐年提高,与靶向治疗的进展,MRI的广泛使用,患者及家属生存要求的不断提高以及临床医生的逐步重视有关。存在基因突变LM患者的TKI靶向治疗十分重要,靶向治疗后LM患者可以挑战加倍剂量或冲击治疗模式,耐受性好并且有一定疗效;培美曲塞ITC治疗可能成为NSCLC患者LM的一种有效治疗手段。
参考文献
[1].Remon J,Le Rhun E,Besse B.Leptomeningeal carcinomatosis in non-small cell lung cancer patients:a continuing challenge in the personalized treatment era[J].Cancer Treat Rev,2017,53:128-137.
[2].Le Rhun E,Galanis E.Leptomeningeal metastases of solid cancer[J].Curr Opin Neurol,2016,29:797-805.
[3].Li YS,Jiang BY,Yang JJ,et al.Leptomeningeal metastases in patients with NSCLC with EGFR mutations[J].J Thorac Oncol,2016,11:1962-1969.
[4].Chamberlain M,Junck L,Brandsma D,et al.Leptomeningeal metastases:a RANO proposal for response criteria[J].Neuro Oncol,2017,19(4):484-492.
[5].Wen PY,Chang SM,Van den Bent MJ,et al.Response assessment in neuro-oncology clinical trials[J].J Clin Oncol,2017,35(21):2439-2449.
[6].Straathof CS,de Bruin HG,Dippel DW,et al.The diagnostic accuracy of magnetic resonance imaging and cerebrospinal fluid cytology in leptomeningeal metastasis[J].J Neurol,1999,246(9):810-814.
[7].Mok TS,Wu YL,Ahn MJ,et al.Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer[J].N Engl J Med,2017,376:629-640.
[8].Hida T,Nokihara H,Kondo M,et al.Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX):an open-label,randomised phase 3 trial[J].Lancet,2017,390:29-39.
[9].Peters S,Camidge DR,Shaw AT,et al.Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer[J].N Engl J Med,2017,377:829-838.
[10].Yang JCH,Kim SW,Kim DW,et al.Osimertinib in patients with epidermal growth factor receptor mutation-positive non-small-cell lung cancer and leptomeningeal metastases:the BLOOM study[J].J Clin Oncol,2020,38(6):538-547.
[11].Clarke JL,Pao W,Wu N,et al.High dose weekly erlotinib achieves therapeutic concentrations in CSF and is effective in leptomeningeal metastases from epidermal growth factor receptor mutant lung cancer[J].J Neurooncol,2010,99(2):283-286.
[12].Zhang I,Zaorsky NG,Palmer JD,et al.Targeting brain metastases in ALK-rearranged non-small-cell lung cancer[J].Lancet Oncol,2015,16:e510-e521.
[13].Johnson TW,Richardson PF,Bailey S,et al.Discovery of (10R)-7-amino-12-fluoro-2,10,16-trimethyl-15-oxo-10,15,16,17-tetrahydro-2H-8,4-(metheno)pyrazolo[4,3-h][2,5,11]-benzoxadiazacyclotetradecine-3-carbonitrile (PF-06463922),a macrocyclic inhibitor of anaplastic lymphoma kinase (ALK) and c-ros oncogene 1 (ROS1) with preclinical brain exposure and broad-spectrum potency against ALK-resistant mutations[J].J Med Chem,2014,57:4720-4744.
[14].Le Rhun E,Weller M,Brandsma D,et al.EANO-ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up of patients with leptomeningeal metastasis from solid tumours[J].Ann Oncol,2017,28:iv84-iv99.
[15].Beauchesne P.Intrathecalchemotherapyfortreatmentof leptomeningeal dissemination of metastatic tumours[J].Lancet Oncol,2010,11:871-879.
[16].Groves MD,Glantz MJ,Chamberlain MC,et al.A multicenter phase II trial of intrathecal topotecan in patients with meningeal malignancies[J].Neuro Oncol,2008,10(2):208-215.
[17].Blaney SM,Heideman R,Berg S,et al.Phase I clinical trial of intrathecal topotecan in patients with neoplastic meningitis[J].J Clin Oncol,2003,21(1):143-147.
[18].van der Gaast A,Sonneveld P,Mans DR,Splinter TA.Intrathecal administration of etoposide in the treatment of malignant meningitis:feasibility and pharmacokinetic data[J].Cancer Chemother Pharmacol,1992,29(4):335-337.
[19].Chamberlain MC,Tsao-Wei DD,Groshen S.Phase II trial of intracerebrospinal fluid etoposide in the treatment of neoplastic meningitis[J].Cancer,2006,106(9):2021-2027.
[20].Sun JM,Nam MH,Chung JY,et al.Safety and pharmacokinetics of intrathecal administration of pemetrexed in rats[J].Cancer Chemother Pharmacol,2011,68(2):531-538.
[21].Pan Z,Yang G,Cui J,et al.A pilot phase 1 study of intrathecal pemetrexed for refractory leptomeningeal metastases from non-smallcell lung cancer[J].Front Oncol,2019,9:838.
[22].Morris PG,Reiner AS,Szenberg OR,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-385.


