Siva-1在胃癌组织中的表达及其临床意义
作者:admin 来源:未知 日期:2021-03-25 08:44人气:
摘 要:
目的 探讨Siva-1在胃癌组织中的表达及其与细胞凋亡的关系。方法 选取2016年1月—2018年12月广西壮族自治区人民医院经手术切除的胃癌组织及癌旁组织各54例。采用qRT-PCR和SP法检测Siva-1mRNA及蛋白的表达水平,分析Siva-1在胃癌组织中的表达及与临床病理特征的关系。结果 胃癌组织中Siva-1阳性表达率较低(P <0.05),Siva-1 m RNA相对表达量较低(P <0.05)。不同肿瘤直径、肿瘤分期患者Siva-1阳性表达率比较,差异有统计学意义(P <0.05)。经Pearson相关性分析,Siva-1 mRNA表达量与肿瘤直径呈负相关(r=-0.376,P <0.05)。结论 Siva-1在胃癌组织中低表达,且与肿瘤的发生、发展有关,可作为诊断胃癌的潜在标志物。
关键词:
胃肿瘤 Siva-1/凋亡诱导因子 肿瘤标记,生物学
Expression and clinical significance of Siva-1 in gastric cancer
Fan-biao Kong Hong-qiang Deng Sheng Xu Xiao-tong Wang Wei Mai Li-ming Pang
Department of Colorectal and Anal Surgery, People's Hospital of Guangxi Zhuang Autonomous Region; Department of Surgical Treatment of Gastrointestinal Hernia and Fistula, People's Hospital of Guangxi Zhuang Autonomous Region;
Abstract:
Objective To detect the expression of Siva-1 in gastric cancer tissue, and to investigate the relationship between Siva-1 expression level and the clinical characteristics of gastric cancer. Methods We selected the gastric cancer tissues and adjacent normal tissues surgically removed in our hospital from January 2016 to December 2018, each with 54 cases. Quantitative real-time polymerase chain reaction(qRT-PCR) and immunohistochemistry were used to detect the mRNA and protein expression of Siva-1 in the gastric cancer and corresponding adjacent normal tissues. The relationship between the expression of Siva-1 and the clinicopathological features was analyzed. Results The expression level of Siva-1 in gastric cancer tissues was significantly lower than that in adjacent normal tissues(P < 0.05). The positive rate of Siva-1 differed in tissues with different tumor diameter and stage(P < 0.05). The correlation analysis further suggested Siva-1 expression negatively correlated with tumor size and pathological grade(P < 0.05). Conclusions Siva-1 is lowly expressed in gastric cancer tissues,and is negatively associated with tumor size and pathological grade, indicating that Siva-1 may play a role in suppressing gastric cancer as a potential biomarker.
Keyword:
gastric cancer; Siva-1/apoptosis inducing factor; biomarker;
胃癌是我国常见的消化道肿瘤之一,每年新发病例约41万[1],严重威胁我国人民的生命健康。随着分子生物学研究的深入,分子靶点及分子标志物的相关研究逐渐成为肿瘤研究的热点。凋亡诱导因子Siva-1已被证实在多种肿瘤中发挥抑制肿瘤细胞生长的功能[2-4],而其与胃癌相关的报道甚少。因此中笔者通过分析Siva-1在胃癌组织中的表达,为探讨Siva-1在胃癌发生、发展中的作用提供理论依据。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年12月广西壮族自治区人民医院经手术切除的胃癌组织及癌旁组织各54例。其中,男性37例,女性17例;年龄24~76岁,中位年龄60岁。胃癌临床分期参照美国肿瘤联合委员会(AJCC)第7版指南标准[5],患者均未接受术前放疗、化疗。鼠抗人Siva-1抗体购于美国Proteintech公司,免疫组织化学试剂盒购自福州迈新技术开发有限生物公司。Trizol试剂、引物及PCR试剂盒购自上海吉凯基因化学技术有限公司。
1.2 方法
1.2.1 检测Siva-1表达
采用SP法检测Siva-1的表达。将石蜡标本进行包埋并连续切片,每片厚度约4μm,利用二甲苯Ⅰ、Ⅱ脱蜡,酒精脱水,3%双氧水灭活,并在枸橼酸钠缓冲液中进行抗原修复。然后根据SP法对石蜡标本进行一抗(鼠抗人Siva-1抗体)、二抗孵育,染色后在光镜下观察计数。磷酸盐缓冲液代替一抗作为阴性对照。
1.2.2 Siva-1阳性结果判断
Siva-1蛋白主要表达于胃癌细胞质中,当细胞质里出现棕黄色或棕褐色颗粒,即说明Siva-1在该细胞中阳性表达。采用双盲法在显微镜下对染色的细胞进行观察和计数。根据细胞的染色程度进行评分:未染色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。另根据染色细胞占视野细胞总数的百分比进行评分,阳性细胞<1%计0分,1%~<25%计1分,25%~<50%计2分,50%~<75%计3分,75%~100%计4分。阳性细胞强度得分与阳性细胞百分比得分的乘积即为SP法总分,其中0分为阴性,1~4分为弱阳性,5~8分为中阳性,9分以上为强阳性。本实验将中阳性以上定义为细胞染色阳性表达。
1.2.3 q RT-PCR
采用q RT-PCR检测胃癌及癌旁组织中Siva-1 m RNA相对表达量。在液氮中研磨组织,按Trizol说明书提取组织总RNA后,利用Thermo Bio Mate 3S紫外/可见光分光光度仪测定RNA纯度(OD值)和蛋白质浓度。OD260/OD280范围为1.8~2.1。按q RT-PCR试剂盒说明书进行逆转录,得到c DNA。反应参数为:16℃、30 min,42℃、30 min,90℃、5 min。反应结束后短暂离心,置于冰上冷却。然后进行RT-PCR扩增反应,95℃预变性10 min,95℃变性15 s,60℃退火1 min,70℃延伸30 s,共40个循环。PCR引物设计合成由上海吉凯基因公司完成(见表1)。采用2-△△ct法测定目标基因m RNA相对表达量,用Data Assist (V3.01)软件进行结果分析。
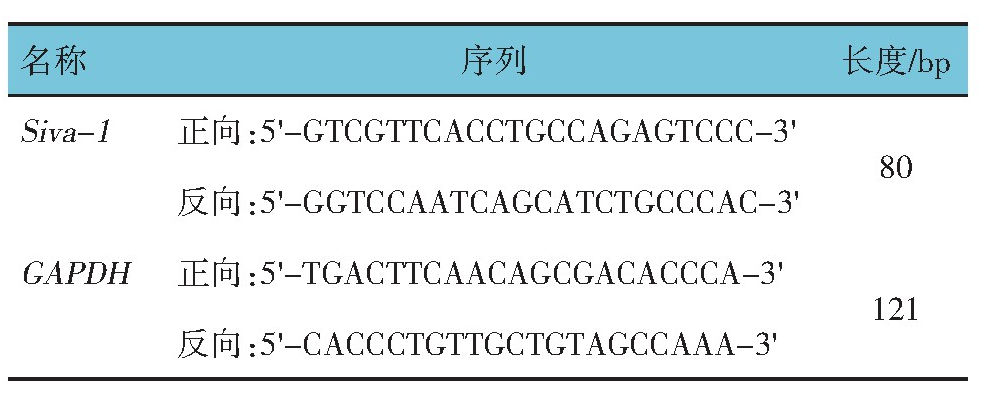
表1 PCR引物序列
1.3 统计学方法
数据分析采用SPSS 19.0统计软件。计数资料以构成比表示,比较用χ2检验,相关性分析用Pearson法,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌及癌旁组织中Siva-1的阳性表达
Siva-1在胃癌组织中的阳性表达率为25.93%(14/54),癌旁组织为94.44%(51/54),经χ2检验,差异有统计学意义(χ2=52.900,P=0.000),胃癌组织中Siva-1的阳性表达低于癌旁组织。见图1。
2.2 胃癌组织与癌旁组织中Siva-1 m RNA表达水平
Siva-1 m RNA在胃癌组织中相对表达量为(6.97±1.32),癌旁组织为(78.06±2.98),经t检验,差异有统计学意义(t=-362.450,P=0.000),Siva-1 m RNA在胃癌组织中低表达。
2.3 不同临床病理特征胃癌患者Siva-1阳性表达率比较
不同年龄、性别、肿瘤分化程度、淋巴转移、神经侵犯、脉管内癌栓患者Siva-1阳性表达率比较,差异无统计学意义(P>0.05);不同肿瘤直径、肿瘤分期患者Siva-1阳性表达率比较,差异有统计学意义(P<0.05)。见表3。
表3 不同临床病理特征的胃癌患者Siva-1阳性表达率比较例(%)
2.4 Siva-1表达水平与肿瘤直径的相关性分析
经Pearson相关性分析,Siva-1 m RNA相对表达量与肿瘤直径呈负相关(r=-0.376,P=0.003)。
3 讨论
凋亡诱导因子Siva-1定位在染色体14q (32-33)上,含有175个氨基酸,在正常组织中均有表达。有研究表明Siva-1在乳腺癌和结直肠癌中的表达水平均低于癌旁正常组织,与本研究结果一致[6-8],说明Siva-1作为凋亡因子,可能在肿瘤中扮演着促进癌细胞凋亡的作用,提示Siva-1在胃癌的发生、发展过程中起着抑制作用,是一个抑癌基因。
本研究发现Siva-1阳性表达率在不同年龄、性别、肿瘤分化程度、淋巴转移、神经侵犯脉管内癌栓患者无差异,在不同肿瘤直径及肿瘤分期患者有差异;且Siva-1 m RNA相对表达量与肿瘤直径呈负相关。即肿瘤直径越大,m RNA相对表达量越低。提示Siva-1存在作为胃癌临床病理分期标志物的可能。但Siva-1 m RNA相对表达量可能与胃癌细胞的侵犯能力无关。
细胞凋亡遵循自身的程序,凋亡的调节对维持体内环境稳态及正常细胞形态至关重要,肿瘤的发生一方面由于肿瘤的过度增生,另一方面是由于细胞凋亡受阻。凋亡过程发生异常也可造成肿瘤增生[9]。近年来,细胞凋亡已成为生物医学的研究热点之一。本研究结果显示:相比癌旁组织,胃癌组织中Siva-1阳性表达率降低,其促凋亡作用减弱,导致肿瘤细胞异常增生,表现为肿瘤体积增大,肿瘤分期级别增高。Siva-1在体内外均能与抑癌基因读码框移位蛋白发生直接作用,促进抑癌基因读码框移位蛋白的泛素化或降解,从而影响P53的稳定性,进而调节细胞周期进程和细胞增殖[10]。Siva-1还可与多种受体结合,通过其N末端与CD27、Bcl-2或Bcl-xl的C末端相结合而发生相互作用,从而调控多条信号通路并促进细胞凋亡,在乳腺癌、结直肠癌等肿瘤细胞中,具有抑制肿瘤细胞生长及转移的作用[7],同时还可以作为化疗药顺铂的增效剂,为肿瘤的靶向治疗提供新的思路[8-10]。通过慢病毒干扰人为下调Siva-1的表达后,胃癌细胞的增殖活性增强,并且胃癌细胞的对化疗药DDP的耐药性也得以提高,与本课题组前期体外实验结果一致[13-15]。Siva-1阳性表达率在有无淋巴结转移患者中无差异,说明Siva-1阳性表达率与肿瘤的转移关系不密切,主要是与肿瘤凋亡关系相关,可作为临床分期标志物。
综上所述,本研究提示Siva-1的表达可能与胃癌细胞个体的生长及凋亡相关,而与细胞侵袭运动无关,其具体机制尚需进一步探索,但随着对Siva-1分子机制的深入研究,其作为潜在的靶向治疗靶点的应用前景非常广泛,尤其是其作为化疗药的增效剂将为肿瘤治疗提供新的思路。
参考文献
[1] CHEN W, SUN K, ZHENG R, et al. Cancer incidence and mortality in china, 2014[J]. Chin J Cancer Res, 2018, 30(1):1-12.
[2] LIU T, MA Y F, WANG Z L, et al. Siva 1 inhibits cervical cancer progression and its clinical prognosis significance[J]. Cancer Manag Res, 2020, 12:303-311.
[3] PARK I K, BLUM W, BAKER S D, et al. E3 ubiquitin ligase Cbl-b activates the p53 pathway by targeting Siva1, a negative regulator of ARF, in FLT3 inhibitor-resistant acute myeloid leukemia[J].Leukemia, 2017, 31(2):502-505.
[4] CHEN G H, XUE Q Q, LI J, et al. Anticancer activity of recombinant siva1 protein in human nasopharyngeal carcinoma cell line CNE-2[J]. Cancer Biomark, 2015, 15(6):833-841.
[5] SOBIN L H, WITTEKIND C. TNM classification of malignant tumors[M]. 7th ed. New York:John Wiley&Sons, 2009:73-77.
[6] LI N, JIANG P, DU W J, et al. Siva1 suppresses epithelialmesenchymal transition and metastasis of tumor cells by inhibiting stathmin and stabilizing microtubules[J]. Proceedings of the National Academy of Sciences, 2011, 108(31):12851-12856.
[7] PRASAD K V, AO Z, YOON Y, et al. CD27, a member of the tumor necrosis factor receptor family, induces apoptosis and binds to Siva, a proapoptotic protein[J]. Proc NatlAcad Sci USA, 1997,94:6346-6351.
[8] OKUNO K, YASUTOMI M, NISHIMURA N, et al. Gene expression analysis in colorectal cancer using practical DNA array filter[J]. Dis Colon Rectum, 2001, 44:295-299.
[9]舒丹,陶德定,龚建平.流式细胞术的亚G1峰法分析细胞凋亡的重新评价[J].中华实验外科杂志, 2000, 17(1):59-60.
[10] WANG X W, ZHA M, ZHAO X C, et al. Siva1 inhibits p53function by acting as an ARF E3 ubiquitin ligase[J]. Nat Commun, 2013, 4:1551.
[11] KATAYAMA Y, SAKAI A, OUE N, et al. A possible role for the loss of CD27-CD70 interaction in myelomagenesis[J]. Br J Haematol, 2003, 120(2):223-234.
[12] BARKINGE J L, GUDI R, SARAH H, et al. The p53-induced Siva-1 plays a significant role in cisplatin-mediated apoptosis[J].J Carcinog, 2009, 8:2.
[13]王晓通,吴锟,李雷,等. shRNA-SIVA1慢病毒载体的构建及其对胃癌细胞耐药性的影响[J].实用医学杂志, 2020, 36(3):282-287.
[14] KONG F B, DENG Q M, DENG H Q, et al. Siva-1 regulates multidrug resistance of gastric cancer by targeting MDR1 and MRP1 via the NF-κB pathway[J]. Molecular Medicine Reports,2020, 22(2):1558-1566.
[15] WANG X T, LI L, KONG F B, et al. Lentivirus-mediated overexpression of Siva-1 reverses cisplatin resistance in gastric cancer in vitro[J]. Cell Biochemistry and Biophysics, 2020, 78(4):455-463.


