靶向卵巢癌叶酸受体α的CAR-NK-92细胞构建及功能鉴定
作者:admin 来源:未知 日期:2021-03-29 09:07人气:
摘 要:
目的 卵巢叶酸受体α(αFR)在上皮性卵巢癌中高表达。文章拟构建靶向αFR的嵌合抗原受体(CAR)修饰NK-92细胞(NK-92-αFR-CAR),并验证其对αFR阳性靶细胞的杀伤效能,为卵巢癌的临床治疗提供新策略。方法 选择偏爱密码子技术设计人源化抗αFR抗原的CAR分子基因;构建慢病毒表达载体pLenti-αFR-CAR;包装慢病毒并感染NK-92细胞;Western blot、qPCR及流式细胞术检测αFR-CAR分子在NK-92细胞中的表达效率。LDH释放实验和ELISA检测NK-92-αFR-CAR细胞对αFR阳性卵巢癌细胞的杀伤活性。结果 双酶切pLenti-αFR-CAR重组质粒可见分子质量和αFR-CAR分子一致的基因片段。Western blot和qPCR证明αFR-CAR分子在NK-92细胞中确有表达,并且经嘌呤霉素筛选后,αFR-CAR的表达效率超过90%。NK-92-αFR-CAR细胞对卵巢癌细胞的杀伤效应及细胞因子分泌水平呈抗原依赖性,即肿瘤细胞表面αFR表达水平越高,NK-92-αFR-CAR细胞对其杀伤效应越强。NK-92-αFR-CAR细胞与SK-OV-3细胞或A2780细胞共培养后,其IFN-γ分泌水平(5 007.81±180.37、2 668.30±180.37)较NK-92细胞(360.80±8.44、285.86±12.39)和NK-92-EV细胞(378.75±21.76、292.10±21.76)表达更高(P<0.01);TNF-α分泌水平(964.27±74.95、585.73±83.53)较NK-92细胞(247.92±5.96、231.03±10.47)和NK-92-EV细胞(230.04±13.66、215.13±7.89)表达更高(P<0.01)。但与A-431细胞共培养,3种细胞中IFN-γ和TNF-α表达差异无统计学意义(P<0.05)。结论 NK-92-αFR-CAR细胞具有分泌大量IFN-γ和TNF-α细胞因子并特异杀伤αFR阳性卵巢癌细胞的能力,这为NK-92-αFR-CAR细胞进入后续的临床前和临床研究奠定了基础。
关键词:
嵌合抗原受体修饰NK-92细胞 卵巢癌 叶酸受体α 肿瘤免疫
Construction and functional identification of NK-92-αFR-CAR targeting ovarian cancer
YANG Yu AO Xiang LI Wei-qiang GUO Wei TAN Yan AO Luo-quan HE Min WANG Zheng-cheng XU Xiang GUO Jian-xin
Department of Gynaecology and Obstetrics, Daping Hospital and Research Institute of Surgery, Army Medical University; First Department, State Key Laboratory of Trauma, Burn and Combined Injury, Daping Hospital and Research Institute of Surgery, Army Medical University;
Abstract:
Objective High mortality and lack of effective treatment are characteristics of ovarian cancer. In recent years, chimeric antigen receptor modified T/NK(CAR-T/NK) cells show extraordinary effect in hematological malignant tumor and is believed to be hopeful to cure cancer. So we aimed to design and construct the third generation chimeric antigen receptor(CAR) that targets folate receptor α(αFR) in ovarian carcinoma, identify its expression on NK-92 cells, evaluate the cytotoxicity of NK-92-αFR-CAR cells on αFR positive cancer cells and eventually to provide a new strategy to treat ovarian cancer. Methods In order to reinforce the expression efficiency, we chose the biased codons technology to build the third generation CAR targeting αFR. The lentiviral expressing vector which carries αFR-CAR gene, pLenti-αFR-CAR,was constructed and then we packaged the lentiviral particles and transfected NK-92 cells. Western Blot, qPCR and flow cytometry were used to detect the expression of αFR-CAR molecule on NK-92 cells. And lastly, we selected lactate dehydrogenase(LDH) releasing test and ELISA assays to assess the killing ability and specificity of our NK-92-αFR-CAR cells on αFR positive ovarian cancer cells. Results After the double enzyme digestion of pLenti-αFR-CAR recombinant lentiviral plasmid, we gained a gene segment which is the same as the αFR-CAR molecule weight. Western Blot and qPCR confirmed the expression of αFR-CAR on NK-92 cells and up to 90% NK-92 cells were transfected with αFR-CAR molecule when detected by flow cytometry after puromycin selection. The cytotoxicity and cytokine releasing level of NK-92-αFR-CAR cells is antigen-dependent, namely the higher antigen the tumor cells express, the stronger cytotoxicity the NK-92-αFR-CAR cells show and the more cytokine the NK-92-αFR-CAR cells release. Conclusion We successfully obtained high purity of NK-92-αFR-CAR cells which display specific killing capability to αFR positive ovarian carcinoma cells and secret massive IFN-γ and TNF-α. And the basic study of NK-92-αFR-CAR lay a foundation for its preclinical and clinical research.
Keyword:
chimeric antigen receptor-modified NK-92 cells; ovarian cancer; folate receptor α; tumor immunology;
0 引 言
卵巢癌是发病率和死亡率最高的妇科肿瘤之一,目前以手术为主、辅以铂类和紫杉醇联合化疗的标准治疗方案并不能明显改善患者预后,卵巢癌患者的5年生存率仍不足30%[1-3]。因此,急需寻找新的卵巢癌治疗策略。
嵌合抗原受体(chimeric antigen receptor, CAR)结构通常包含识别肿瘤相关抗原的单链抗体(single chain fragment variable, scFv)和共刺激分子(costimulatory molecule, CM), 通常为CD28、CD134或CD137,以及细胞内信号域免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAM),通常为CD3䥺SymbolzA@或FcεRIγ[4]。基于这种特殊的结构,表达CAR的免疫效应细胞能不依赖于MHC限制性和抗原提呈而特异性识别并杀伤靶细胞[5-6]。目前已有多项临床试验证实,CAR修饰的免疫细胞对白血病、淋巴瘤等多种恶性肿瘤治疗有效[5,7-8]。CAR技术的关键在于寻找肿瘤特异性或相关性的抗原[9]。αFR是一种糖基磷脂酰肌醇耦联蛋白,在正常组织中不表达或限制性低表达,但在90%的上皮性卵巢癌中高表达,并且其表达水平不受化疗药物的影响,故被认为是靶向治疗卵巢癌的理想抗原[10]。近期的研究认为,自然杀伤细胞本身就具有直接识别杀伤肿瘤细胞等特性,或许是更好的CAR负载细胞[11]。但目前,靶向αFR的CAR修饰NK-92细胞报道较少。
综上所述,本研究利用抗αFR的人源化抗体C4设计了靶向αFR的CAR(abti-αFR chimeric antigen receptor, αFR-CAR),将该αFR-CAR基因构建到pLenti-EF1α-MCS-T2A-Puro慢病毒表达载体上,包装慢病毒感染NK-92细胞,制备NK-92-αFR-CAR细胞,鉴定CAR分子在NK-92细胞上的表达,并在细胞水平上进行功能实验,为下一步进行NK-92-αFR-CAR细胞的临床前和临床研究奠定基础。
1 材料与方法
1.1 细胞株及主要试剂
人自然杀伤细胞系NK-92由美国俄亥俄州立大学余建华教授赠予,用含12.5%胎牛血清、12.5%马血清的α-MEM培养基培养。293FT细胞株由本实验室保存,人卵巢腺癌细胞系SK-OV-3和人皮肤鳞癌细胞系A-431由中国科学院干细胞库提供,人卵巢癌细胞A2780细胞购买于Sigma-Aldrich公司,用含10%胎牛血清的DMEM-HG培养基培养。大肠埃希菌E.coli TOP10菌株由本实验室保存。
寡核苷酸引物和第3代αFR-CAR分子的合成由金斯瑞公司完成,酶切后获得的基因片段由华大基因科技服务有限公司完成DNA测序。逆转录试剂盒、限制性内切酶、DNA纯化回收试剂盒和SYBR© Premix Ex TaqTMII均购于Takara公司。马血清和α-MEM培养基均购于Gibco公司,胎牛血清和DMEM-HG培养基购于BI公司。PE耦联的小鼠抗人FOLR1抗体购自R&D SYSTEMS公司,FITC耦联的山羊抗人IgG Fc抗体购自Jackson ImmunoResearch公司,兔CD3ζ多克隆抗体购于Abcam公司,PolyJetTM试剂购于SignaGen公司,Polybrene试剂购于Santa Cruz Biotech公司,BCA蛋白提取试剂盒购于碧云天公司。慢病毒表达载体pLenti-EF1α-MCS-T2A-Puro质粒及其相应的辅助质粒均购于上海和元公司。Cytotoxicity LDH Assay Kit-WST试剂盒购于同仁公司,IFN-γ ELISA试剂盒和TNF-α ELISA试剂盒购于博士德公司。
1.2 αFR-CAR分子的设计
选择CD8α信号肽,人源化单克隆抗体C4的scFv、IgG1 Fc段、CD8α铰链区,CD28跨膜域以及共刺激分子CD28、CD137和CD3ζ链的细胞内信号结构域为基础,通过相应的连接链将这些结构串联,获得αFR-CAR分子。
1.3 慢病毒表达载体构建及基因片段测序分析
通过人工合成获得αFR-CAR基因并利用基因重组将其插入到pLenti-EF1α-MCS-T2A-Puro表达载体上,获得pLenti-αFR-CAR慢病毒表达载体。利用XbaⅠ和BamH Ⅰ限制性内切酶双酶切pLenti-αFR-CAR质粒,将酶切产物进行凝胶电泳,利用DNA纯化回收试剂盒回收酶切DNA片段并进行测序分析,验证pLenti-αFR-CAR载体上αFR-CAR基因的正确性。
1.4 携带αFR-CAR基因的慢病毒的包装及浓缩
293FT细胞提前用10 cm皿铺板,当细胞汇合度达70%时进行换液,加入已用PolyJet进行预处理的慢病毒pLenti-αFR-CAR质粒及其相应的辅助质粒,轻柔颠倒混匀,室温静置20 min。然后将此复合物加入到293FT细胞培养皿中,培养24 h后弃掉上清液,加入DMEM-HG完全培养基。72 h后收集上清液,0.45 μm滤器过滤,再补加DMEM-HG完全培养基10 mL,隔天再收集一次上清液。两次收集的病毒上清按4∶1加入相应的PEG8000溶液,离心后用 DMEM-HG培养基重悬病毒沉淀,每20微升进行分装,-80 °C备用。
1.5 慢病毒滴度的测定
将293FT细胞接种于96孔板中,10 000个细胞/孔,共10孔,培养过夜。利用DMEM-HG完全培养基10倍梯度稀释收集到的病毒浓缩液,共10个稀释梯度。将96孔板的旧培养基吸弃,加入稀释的病毒液,做好标记,培养48 h。荧光显微镜下观察结果,选取能进行计数的孔并计数荧光克隆数,并根据稀释倍数进行计算,公式如下:
病毒滴度(TU/mL)=荧光克隆数×该孔对应的稀释倍数
1.6 αFR-CAR慢病毒感染NK-92细胞
NK-92细胞计数,按105个细胞/孔将其接种至6孔板,共3个孔,然后置于细胞培养箱培养4 h。按照感染复数(multiplicity of infection,MOI)为10的比例加入空载慢病毒颗粒(empty vector, EV)和αFR-CAR慢病毒颗粒,再向每孔加入8 μg/mL的Polybrene,并进行标注。96 h后向培养液中加入终浓度为5 mg/mL的嘌呤霉素。
1.7 细胞总蛋白的提取及Western blot检测
分别收集NK-92、NK-92-EV、NK-92-αFR-CAR细胞沉淀,加入RIPA,置于冰上裂解细胞10 min后取上清,用BCA法检测蛋白浓度,按照上样量50 μg计算所需上清体积,加入适量的RIPA和5×Loading Buffer,煮沸5 min,80 °C保存。配制聚丙烯酰胺凝胶,上样,蛋白样品经蛋白凝胶电泳分离后进行电转,转移至PVDF膜上,封固,洗膜,加入兔抗人CD3ζ抗体,4 °C轻摇过夜。洗膜后加入HRP标记的山羊抗兔IgG抗体。ECL显色液显色后利用Bio-Rad ChemiDocTM成像系统采集图像。
1.8 RNA的抽提、逆转录和qPCR
分别收集NK-92、NK-92-EV、NK-92-αFR-CAR细胞沉淀,加入Trizol裂解液进行裂解,按照RNA抽提试剂盒说明书依此加入氯仿、异丙醇和75%乙醇,RNA沉淀干燥10 min后加入无RNA酶的水,使其完全溶解后进行浓度测定。按照试剂盒说明书,利用PrimeScriptTM reagent Kit with gDNA Eraser对抽提的3种细胞的总RNA进行基因组DNA去除反应。随后将获得的反应液按说明书进行逆转录反应,得到cDNA溶液。按照试剂盒说明书,利用获得的cDNA溶液、SYBR© Premix Ex TaqTMII和GAPDH以及αFR-CAR的引物(GAPDH:正向引物5'- GCACCGTCAAGGCTGAGAAC-3',反向引物5'-TGGTGAAGACGCCAGTGGA-3';αFR-CAR:正向引物5'- GAAGAAGAGGAGGGCGGCTGC-3',反向引物5'- GGCCCAGGTTCAGCTCGTTGTA-3')配置qPCR反应液,qPCR反应程序:95 °C×30 s→95 °C×5 s→60 °C×40 s,40 个循环。根据目的基因以及内参基因的Cq值比较分析mRNA的相对表达水平。
1.9 流式细胞术检测
收集SK-OV-3、A2780和A-431 3种肿瘤细胞各105于1.5mL EP管中,离心半径8 cm、1000 r/min 离心5 min,弃上清,50 μL PBS重悬,加入3 μL αFR的流式抗体或同型对照,混匀,避光室温孵育30 min,PBS洗涤后流式细胞检测仪检测3种肿瘤细胞靶抗原的表达情况。分别收集NK-92、NK-92-EV、NK-92-αFR-CAR细胞,1.5 mL离心管,离心半径8 cm、1000 r/min离心5 min,弃上清,用PBS洗涤1次,再用100 μL PBS重悬细胞并加入FITC耦联的山羊抗人IgG Fc抗体,室温孵育30 min后流式细胞仪检测NK-92细胞膜表面抗体标记情况,FITC检测阳性即为αFR-CAR分子表达阳性。
1.10 LDH释放实验检测细胞杀伤效应
按照试剂盒说明书,在96孔板中设置效应细胞加靶细胞LDH释放孔(effector release, ER)、效应细胞自发LDH释放孔(effector spontaneous release, ESR)、靶细胞自发LDH释放孔(target spontaneous release, TSR)、靶细胞最大LDH释放孔(target maximum release, TMR)、空白培养基孔(control medium bufferCMB)和体积校正孔(volume correction controlVCC),每类设置3个复孔。向相应孔中接种靶细胞(肿瘤细胞),3000个细胞/孔,并加入50 μL无血清的RPMI 1640培养基培养。次日,按不同效靶比制备NK-92、NK-92-EV、NK-92-αFR-CAR细胞悬液,加入相应孔中。效靶细胞共培养18 h后,向TMR孔和VCC孔中加入Lysis Buffer裂解细胞30 min,再向所有孔中加入Working Solution,室温避光5 min后加入Stop Solution,利用酶标仪测量各孔溶液在490 nm波长处的A值。公式如下:
杀伤效率=(ER-ESR-TSR+CMB)/(TMR-VCC-TSR+CMB)×100%
1.11 ELISA检测效应细胞IFN-γ和TNF-α的分泌水平
在24孔板中接种靶细胞,2×104个细胞/孔,过夜培养后,向孔中加入4×105个效应细胞(NK-92、NK-92-EV或NK-92-αFR-CAR细胞)。效靶细胞共培养24 h后,收集各孔中的培养基上清,然后按ELISA试剂盒说明书操作,检测各孔培养基上清中IFN-γ和TNF-α的浓度。
1.12 统计学分析
采用Graphpad Prism 6.0和SPSS 13.0对实验数据进行统计学分析,定量资料以均数±标准差(x¯±s)表示,杀伤效率及细胞因子分泌结果分析采用单因素方差分析。以P≤0.05为差异有统计学意义。
2 结 果
2.1 αFR-CAR分子的结构设计
CAR的细胞外段由CD8α信号肽、来源于抗αFR的人源化单抗C4的scFv及人IgG1 Fc段组成,跨膜段为CD28分子的跨膜结构域,细胞内段包含CD28、CD137和CD3ζ细胞内信号结构域。见图1。
图 1 第3代αFR-CAR的结构示意图

2.2 αFR-CAR慢病毒表达载体的构建
通过双酶切鉴定实验发现,酶切后有一条2000 bp左右的基因片段,而空载质粒则不一样,见图2。同时,回收该基因片段并进行DNA测序,结果证实该基因片段的序列与设计的αFR-CAR分子的DNA序列一致,说明成功构建pLenti-αFR-CAR慢病毒表达载体,见图3。
图 2 αFR-CAR表达载体
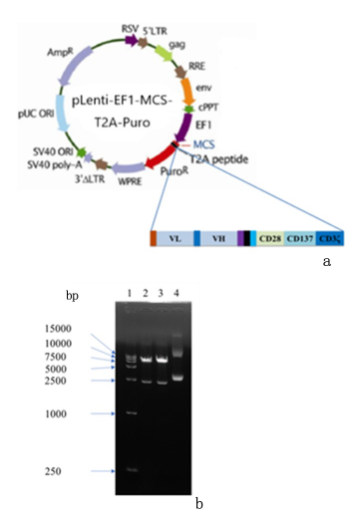
图 3 αFR-CAR DNA片段测序结果
2.3 αFR-CAR分子在NK-92细胞膜上的表达
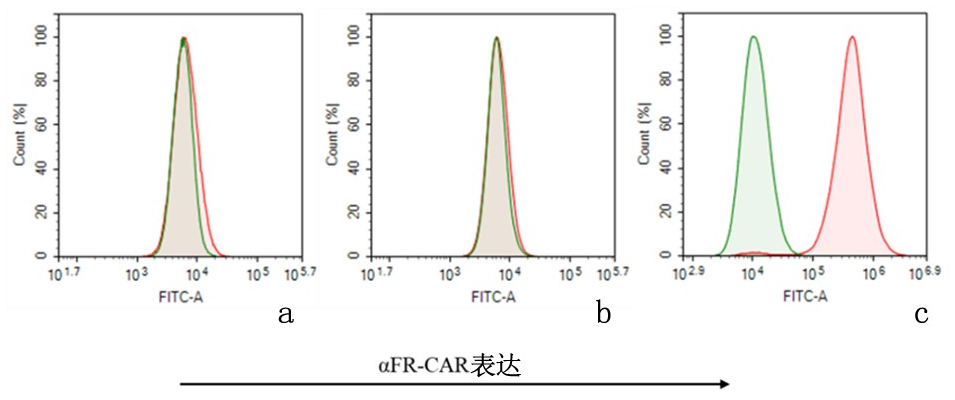
结果显示,经嘌呤霉素筛选后,NK-92-αFR-CAR上αFR-CAR分子的表达效率超过90%,而NK-92和NK-92-EV未见αFR-CAR分子的表达。见图4。
图 4 流式细胞检测NK-92细胞上αFR-CAR分子的阳性表达效率

2.4 αFR-CAR分子在NK-92细胞内的表达 Western blot
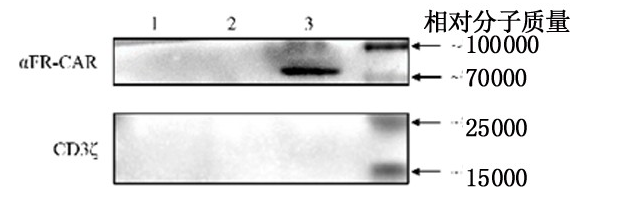
结果显示,αFR-CAR分子在NK-92-αFR-CAR细胞中高表达,而在NK-92细胞和NK-92-EV细胞中未见表达。q-PCA法结果显示,NK-92细胞、NK-92-EV细胞和NK-92-αFR-CAR细胞中αFR-CAR分子表达分别为0±0.08、0.78±0.11、2 581.20±311.84。见图5。
图 5 翻译水平上αFR-CAR分子的表达
2.5 NK-92-αFR-CAR细胞的肿瘤杀伤活性
LDH释放实验结果显示:相较于NK-92细胞和NK-92-EV细胞,NK-92-αFR-CAR细胞可明显杀伤SK-OV-3细胞和A2780细胞(P<0.05),且杀伤效应随着效靶比升高而增强;但NK-92细胞和NK-92-EV细胞的杀伤效应差异无统计学意义(P>0.05)。对于A-431细胞,NK-92细胞、NK-92-EV细胞和NK-92-αFR-CAR细胞的杀伤效应差异无统计学意义(P>0.05)。见图6。
2.6 NK-92-αFR-CAR细胞的IFN-γ和TNF-α分泌能力
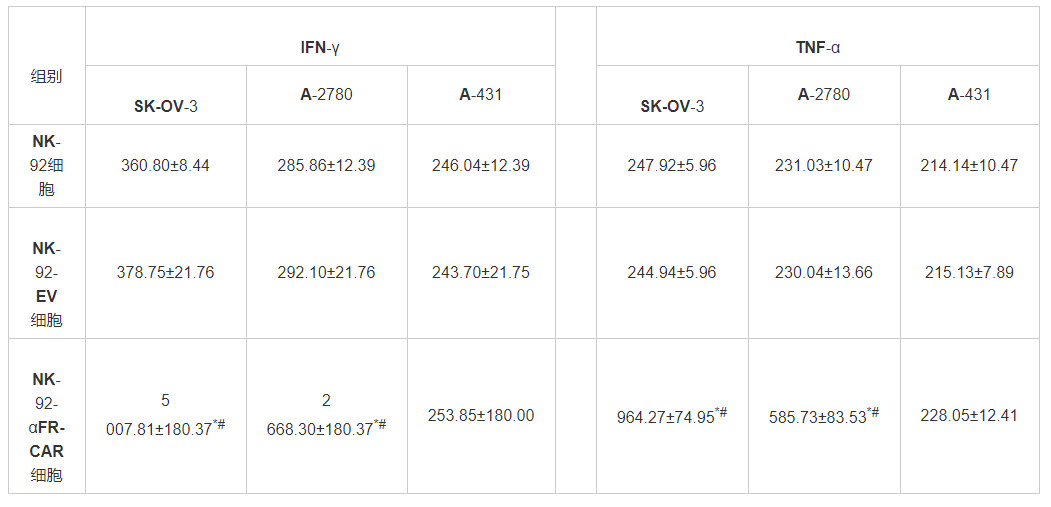
相较于NK-92细胞和NK-92-EV细胞,NK-92-αFR-CAR细胞与SK-OV-3细胞或A2780细胞共培养后,其IFN-γ和TNF-α分泌水平显著更高(P<0.01);但与A-431细胞共培养,3种细胞中IFN-γ和TNF-α表达差异无统计学意义(P>0.05)。见表1。
图 6 NK-92-αFR-CAR细胞对αFR阳性肿瘤细胞的特异杀伤能力比较
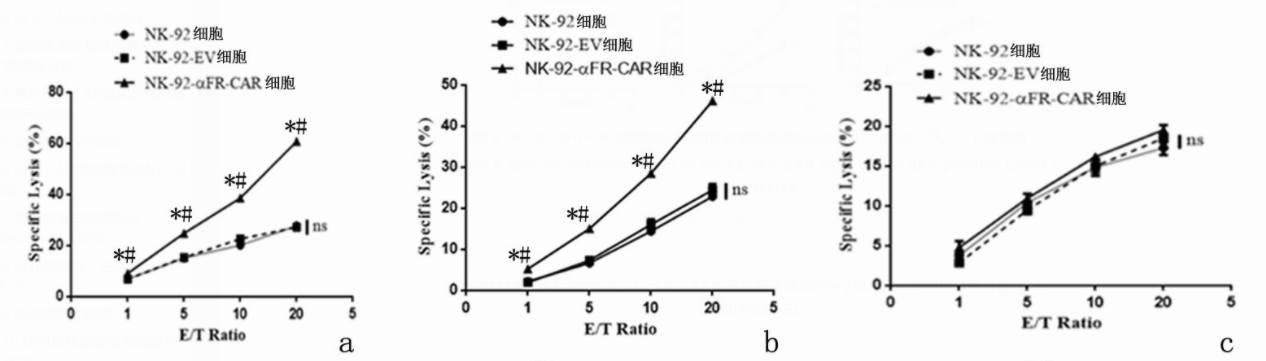
表 1 ELISA技术检测的NK-92-αFR-CAR细胞抗原依赖的IFN-γ和TNF-α细胞因子的分泌(x¯±s)
3 讨 论
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,也是女性中最常见的肿瘤性致死原因之一。尽管针对卵巢癌的手术治疗、化疗和放疗在不断改进,目前统计数据表明,卵巢癌患者的5年生存率并未得到显著提升。相反,还出现了化疗耐药、高复发率等问题[12]。因此,迫切需要寻找更有效的治疗方法。
随着肿瘤免疫学理论和技术的发展,以CAR修饰免疫细胞为代表的过继性细胞免疫治疗在肿瘤治疗中的作用日益凸显。尤其是在血液系统肿瘤中,CAR修饰免疫细胞表现出了极为出色的临床疗效。2017年,美国食品药品监督管理局先后批准了两款CAR修饰T细胞产品,用于治疗急性淋巴细胞白血病和淋巴瘤。此外,已有多项研究证实,CAR修饰免疫细胞对多种肿瘤如胶质母细胞瘤、乳腺癌等具有良好疗效[13]。这些研究结果表明,恶性肿瘤患者有望迎来更有效的“活细胞治疗药物”。
近年来,基于免疫细胞活化的信号通路机制,研究者将共刺激分子(如CD28、CD134、CD137等)引入CAR结构中,发展出第二代CAR(含一个共刺激分子)和第三代CAR(含两个共刺激分子)。研究发现,相比于第一代和第二代CAR,第三代CAR能赋予负载细胞更强的肿瘤杀伤活性和增殖能力,以及更长的存活时间[14]。然而,目前应用于临床研究的CAR多为第二代,第三代CAR的研究尚少。
在早期构建靶向αFR的CAR时,使用的是来源于鼠源性抗体MOv18的scFv。虽然临床试验结果证明了基于该scFv构建的CAR的安全性,但CAR修饰T细胞在患者体内存在时间较短,无法产生有效的抗肿瘤活性[15]。究其原因,可能是患者体内出现了人抗鼠抗体,导致了CAR修饰T细胞活性下降。此外,目前关于CAR修饰免疫细胞的研究大多关注于CAR修饰T细胞。但近期的研究发现,NK细胞本身表达多种活化性受体,可以直接识别并杀伤肿瘤细胞。而且,其在体内循环周期有限,释放的细胞因子谱副作用较小[11,16-17]。因此,NK细胞被认为是另一种较佳的CAR负载细胞。
综上所述,本研究以卵巢癌中高表达的αFR为靶点,设计并构建完全人源化的第三代CAR,包装慢病毒并感染NK-92细胞,获得NK-92-αFR-CAR细胞。经体外细胞实验证实,该NK-92-αFR-CAR细胞不仅能特异性杀伤αFR阳性的卵巢癌细胞,还能抗原特异性地分泌细胞因子。本研究获得的结果,为进一步开展NK-92-αFR-CAR细胞的临床前和临床研究奠定了基础。
参考文献
[1] Eisenhauer EA.Real-world evidence in the treatment of ovarian cancer[J].Ann Oncol,2017,28(suppl_8):i61-i65.
[2] Wills B,Fan Q,Alexander C,et al.Confusion following Treatment of Ovarian Cancer[J].Am J Med,2019.
[3] 刘琦.卵巢癌治疗的决策[J].医学研究生学报,2010,23(11):1123-1126.
[4] 李涛,蒋伟,季国忠,等.嵌合抗原受体T细胞疗法治疗实体肿瘤的研究进展[J].医学研究生学报,2019,32(8):886-890.
[5] Jensen MC,Riddell SR.Design and implementation of adoptive therapy withchimeric antigen receptor-modified T cells[J].Immunol Rev,2014,257(1):127-144.
[6] 冯振卿.嵌合抗原受体T细胞治疗实体瘤的再思考[J].医学研究生学报,2019,32(4):337-340.
[7] Maude SL,Frey N,Shaw PA,et al.Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia[J].New Engl J Med,2014,371(16):1507-1517.
[8] Porter DL,Levine BL,Kalos M,et al.Chimeric Antigen Receptor-Modified T Cells in Chronic Lymphoid Leukemia[J].New Engl J Med,2011,365(8):725-733.
[9] Coulie PG,Van den Eynde BJ,van der Bruggen P,et al.Tumour antigens recognized by T lymphocytes:at the core of cancer immunotherapy[J].Nat Rev Cancer,2014,14(2):135-146.
[10] Walters CL,Arend RC,Armstrong DK,et al.Folate and folate receptor alpha antagonists mechanism of action in ovarian cancer[J].Gynecol Oncol,2013,131(2):493-498.
[11] Borrego F,Larrucea S,Solana R,et al.Editorial:NK Cell-Based Cancer Immunotherapy[J].Front Immunol,2016,7.00249
[12] Orr B,Edwards RP.Diagnosis and Treatment of Ovarian Cancer[J].Hematol Oncol Clin North Am,2018,32(6):943-964.
[13] Zhang C,Burger MC,Jennewein L,et al.ErbB2/HER2-Specific NK Cells for Targeted Therapy of Glioblastoma[J].J Nat Cancer Inst,2016,108(5):djv375
[14] Carpenito C,Milone MC,Hassan R,et al.Control of large,established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains[J].Proc Natl Acad Sci USA,2009,106(9):3360-3365.
[15] Kandalaft LE,Powell DJ,Coukos G.A phase I clinical trial of adoptive transfer of folate receptor-alpha redirected autologous T cells for recurrent ovarian cancer[J].J Transl Med,2012,10(1):157.
[16] Rezvani K,Rouce RH.The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer[J].Front Immunol,2015,6:578.
[17] Rezvani K,Rouce R,Liu E,et al.Engineering Natural Killer Cells for Cancer Immunotherapy[J].Mol Ther,2017,25(8):1769-1781.


