卵巢癌SKOV3细胞外泌体分泌水平及其对顺铂敏感性的影响
作者:mac 来源:赛文期刊 日期:2021-05-10 09:04人气:
摘 要:目的:探究卵巢癌SKOV3细胞外泌体分泌水平与其顺铂敏感性的关系。方法:用超速离心法提取卵巢癌细胞外泌体,透射电镜与纳米粒径示踪分析(NTA)外泌体形态与粒径大小,Western blot检测外泌体表面标志性蛋白水平,电感耦合等离子体质谱计检测外泌体中顺铂含量,CCK-8检测细胞增殖情况,流式细胞凋亡术检测细胞凋亡情况。结果:外泌体纳米粒径示踪分析检测示:卵巢癌细胞外泌体释放水平与外泌体抑制剂GW4869水平呈浓度依赖性,随着抑制剂浓度的增加,卵巢癌外泌体分泌减少。CCK-8实验与流式凋亡检测实验结果显示:随着卵巢癌细胞外泌体释放水平的降低,其对于顺铂敏感性增强。电感耦合等离子体质谱计检测示:外泌体能够携带一部分顺铂外排,并且随着外泌体释放水平的降低,外泌体外排的顺铂含量也逐渐降低,而细胞内顺铂含量逐渐增加,从而对顺铂敏感性增强。结论:卵巢癌SKOV3细胞可通过外泌体外排顺铂,抑制外泌体释放可增强肿瘤细胞的顺铂敏感性。
关键词:卵巢癌 外泌体 敏感性 顺铂
Effect of the exosome secretion level on cisplatin sensitivity in ovarian cancer SKOV3 cells
QIAN Luomeng ZHOU Fuxing CHEN Biliang
Department of Gynecology and Obstetrics,the First Affiliated Hospital of Air Force Medical University;
Abstract:Objective:To investigate the relationship between the level of SKOV3 exosomes secretion and cisplatin sensitivity in ovarian cancer cells.Methods:Exosomes were isolated from SKOV3 cells by ultracentrifugation.Transmission electron microscopy(TEM) and nanosight nanoparticle tracking analysis(NTA) were conducted to analysis the morphology and particle size of exosomes.Western blot was conducted to detect the expression of the markers of exosomes.Inductively coupled plasma mass spectrometer(ICP-MS) was conducted to detect the cisplatin in exosomes and cells, CCK-8 was conducted to detect cell proliferation and the cell apoptosis was detected by flow cytometry.Results:The exosomes of SKOV3 cells were successfully isolated and the release level of exosomes was dose-dependent with the inhibitor GW4869.When the GW4869 concentration increased, the exosome secretion of SKOV3 cells decreased.CCK-8 and flow cytometry experiment showed that the sensitivity of SKOV3 cells to the cisplatin increased with the secretion of exosomes decrease.ICP-MS detected that exosomes could transfer part of cisplatin outside the cells and the cisplatin in SKOV3 cells gradually decreased, thus the sensitivity to cisplatin of SKOV3 cells was decreased.Conclusion:SKOV3 cells transfer cisplatin through exosomes outside the cells and inhibiting the exosomes secretion increase the cisplatin sensitivity of SKOV3 cells.
Keyword:ovarian cancer; exosome; sensitivity; cisplatin;
卵巢癌作为女性生殖系统中死亡率最高的恶性肿瘤,发病率占所有妇科肿瘤的2.5%[1],由于卵巢癌发病隐匿并且缺乏早期有效诊断指标,许多患者确诊时已为晚期,且伴有全身广泛转移[2]。卵巢癌的主要治疗方法为手术联合以铂类药物为基础的化学治疗[3],但85%的卵巢癌患者在完成化疗后出现复发,导致晚期卵巢癌患者的生存率不高[4],主要原因是患者对化疗药物产生耐药[5]。因此探究卵巢癌化疗耐药的发生机制对于寻找新的、有效的治疗手段尤 为重要。
外泌体是由多种细胞分泌的,直径为30~150 nm的胞外囊泡[6],外泌体内含有mRNA、蛋白质、脂质等多种物质[7]。外泌体可在细胞之间进行信息与物质的传递[8],参与调控细胞分化与组织发育。研究表明,外泌体与细胞之间有四种形式的信息交流:①外泌体作为信号复合物去刺激靶细胞;②外泌体能在细胞间传递受体;③外泌体能向受体细胞传递功能性蛋白;④外泌体能向受体细胞传递基因信息。这几种信息交流在肿瘤的发生、发展、侵袭、转移中起着至关重要的作用[9]。越来越多的研究发现,在物质传递方面,外泌体可作为载体进行靶向治疗药物的传递[10-11],可见外泌体的物质传递作用在肿瘤微环境中尤为重要,但外泌体是否能将卵巢癌细胞内的化疗药物顺铂外排至胞外从而降低细胞内药物浓度缺乏相关报道,本文通过抑制卵巢癌SKOV3细胞外泌体分泌,探讨外泌体能否参与化疗药物外排,进而影响卵巢癌细胞对于化疗药物顺铂的敏感性。
1 材料与方法
1.1 细胞株及细胞培养
人卵巢癌细胞株SKOV3购自中国科学院典藏细胞库,由空军军医大学第一附属医院妇产科实验室液氮保存,将胎牛血清40 500 r/min, 4 ℃离心12 h, 取上清0.22 μm过滤器过滤后澄清液体即为无外泌体血清。SKOV3细胞株从液氮中取出后,37 ℃恒温水浴融化,加入含10%的无外泌体血清的McCoy's 5A培养基中,离心去上清,加入培养基重悬细胞,接种于10 cm培养皿中,于37 ℃、5%CO2培养箱中培养,当细胞生长至80%时,用胰蛋白酶消化,并用完全培养基传代,保持细胞处于对数期用于后续实验研究。
1.2 主要试剂与仪器
McCoy's 5A培养基(12330031)购于美国Thermo Fisher公司,0.25%胰蛋白酶(00620010)购于北京沃卡威生物公司;胎牛血清(70220-8611)购于浙江天杭生物公司;CD63抗体(25682-1-AP)购于美国Proteintech公司,HSP70(ab79852)抗体购于英国Abcam公司;外泌体抑制剂GW4869(6823-69-4)购于美国MCE公司;羊抗兔IgG抗体(BA1054)、BCA蛋白定量试剂盒(AR0146)、CCK-8试剂盒(AR1160-500)均购于武汉博士德公司;Western blot凝胶试剂盒(P0012A)购于上海碧云天公司;流式凋亡检测试剂盒(KGA107)购于南京凯基生物公司。超速离心机(optimaLE-80K,美国Beckman公司),纳米粒径示踪分析仪(Zeta View PMX110,德国Particle Metrix公司),透射电镜(H-7650,日本HITACHI公司),电感耦合等离子体质谱计(NexIONTM 350D,美国PerkinElmer公司)。
1.3 超速离心法
将细胞种植于10 cm大皿中,待细胞生长至90%,收集细胞上清于合适体积离心管中,300×g, 4 ℃离心5 min, 离心结束后将细胞上清转移至新的离心管,2 000×g, 4 ℃离心20 min, 离心结束后收集细胞上清于合适体积离心管中,10 000×g, 4 ℃离心30 min, 离心结束后用孔径为0.22 μm的过滤器将细胞上清过滤至超速离心管中,120 000×g离心70 min后用PBS重悬管底沉淀,将重悬 液转移至超速离心 管中,120 000×g离心70 min后可见管底白色沉淀即为外泌体。
1.4 透射电镜检测
将提取的外泌体溶于50~100 μL 2%多聚甲醛溶液中,取5~10 μL外泌体溶液加到Formvar-carbon载样铜网上,取100 μL PBS加到封口膜上,用镊子将铜网(Formvar膜面朝下)放在PBS液滴上清洗,50 μL 1%戊二醛液滴上5 min, 100 μL ddH2O中洗2 min(洗8次),50 μL草酸双氧铀液滴上(pH 7.0)5 min, 50 μL甲基纤维素液滴上10 min, 冰上操作,放到样品台顶端的不锈钢环上,在滤纸上吸去多余液体,空气干燥5~10 min, 最后将铜网放在样品盒里,80 kV下拍摄电镜照片 。
1.5 外泌体纳米粒径示踪分析(NTA)
用水稀释样本,颗粒浓度在1×107/mL和1×109/mL范围内。采用Zeta View PMX110 仪器在405 nm激光下测定样本中粒子数量和大小。以30张/秒拍摄照片,持续时间为1 min。根据检测结果采用NTA 软件(ZetaView8.02.28)分析颗粒的运动并计算外泌体数量,计算公式为:外泌体数量=浓度×测量体积×稀释倍数。
1.6 Western blot检测蛋白表达
弃去细胞上清,用PBS清洗两遍,加入适量RIPA裂解液于细胞中,裂解,离心并收集上清即为总蛋白,并用BCA法对提取到的蛋白进行浓度定量检测。将蛋白上样进行凝胶电泳,后半干法转PVDF膜。用5%的脱脂奶粉进行封闭,一抗溶液(兔抗CD63及HSP70单克隆抗体,稀释度1∶1 000)孵育,4 ℃摇床过夜。二抗溶液(羊抗 兔IgG,稀释度1∶5 000)室温缓慢摇床孵育1 h, 滴加ECL曝光液,在凝胶成像系统中曝光。
1.7 电感耦合等离子体质谱计检测
将提取的外泌体或细胞用70 μL RIPA裂解液充分裂解,上机检测。将仪器参数设为射频发生器功率1 075 W,雾化气流量0.875 L/min, 辅助气流量1.45 L/min, 等离子体气流量16.0 L/min, 样品提升率0.8 mL/min, 采样时间100 ms, 积分时间10 s, 碰撞/反应池模式Standard。根据测量结果计算原样品含量。计算公式为:y=9 338x+620(y为元素响应强度,x为浓度)。
1.8 CCK-8实验检测细胞增殖情况
将卵巢癌细胞在显微镜下进行细胞计数后按照实验设计分组顺序接种于96孔板,于37 ℃、5%CO2培养箱中孵育。按照实验设计加入不同浓度的药物处理细胞,继续将细胞置于培养箱中孵育,达到孵育时间终点时,除去细胞培养液,每孔加入含10 μL CCK-8溶液的新鲜培养基,培养箱孵育2 h。酶标仪测定450 nm波长处的吸光值,根据吸光值绘制生长曲线。
1.9 流式细胞术检测细胞凋亡
收集细胞培养液,用不含EDTA的胰酶消化细胞收集,用PBS洗涤细胞两次收集(1~5)×105细胞,加入500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium lodide混匀,室温避光反应5 min, 按照流式细胞仪操作步骤进行上机检测,利用CFlowPlus软件进行分析。
1.10 统计学方法
应用SPSS 19.0版统计软件进行数据处理,多组数据之间比较采用ANOVA检验,两两比较采用t检验,所有实验重复至少3次,以P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌细胞系SKOV3外泌体的分离、提取与鉴定
超速离心法分离提取卵巢癌细胞系SKOV3外泌体,通过透射电镜观察到外泌体特异性盘状结构(图1A)。Western blot检测外泌体表面标志性蛋白CD63、HSP70与ALIX表达,可见明显条带(图1B)。NTA检测结果显示,卵巢癌细胞系SKOV3样本颗粒的粒径分布峰值为125.8 nm, 样本粒径平均值为118.3 nm, 符合外泌体的粒径范围(图1C)。以上实验证实超速离心法分离提取的样本为外泌体。
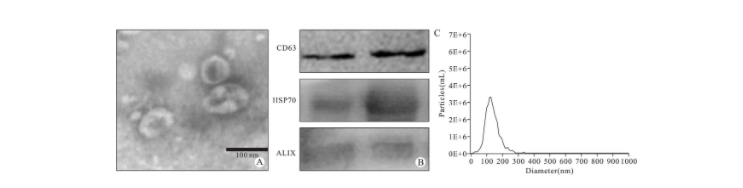
图1 外泌体的分离、提取与鉴定
2.2 GW4869对卵巢癌细胞系SKOV3外泌体释放的抑制作用呈浓度依赖性
为了研究GW4869对于卵巢癌细胞外泌体释放的抑制作用,我们按照0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L设置GW4869浓度梯度,分别处理卵巢癌细胞系SKOV3,并通过外泌体纳米粒径示踪分析计算外泌体数量,可以看出随着GW4869浓度的增加,卵巢癌细胞外泌体分泌数量呈递减趋势(图2),较0 μmol/L组相比,差异均有统计学意义(P<0.01),说明卵巢癌外泌体释放水平随着GW4869浓度增加而降低,后续试验我们选择抑制效果相对较好的20 μmol/L作为处理浓度。
图2 GW4869对卵巢癌细胞外泌体释放的抑制作用呈梯度依赖性(**P<0.01)
2.3 卵巢癌细胞系SKOV3外泌体释放水平影响其对顺铂的敏感性
为了进一步探究卵巢癌细胞外泌体释放水平是否影响其对顺铂的敏感性,首先我们按照1 μg/mL、2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL、32 μg/mL、64 μg/mL设置顺铂浓度梯度,处理SKOV3细胞并通过CCK-8实验发现,SKOV3的IC50为4.726(图3A),因此选择5 μg/mL进行后续实验。按照0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L设置GW4869浓度梯度,并用顺铂(5 μg/mL)处理细胞24 h后,CCK-8实验发现,随着GW4869浓度增加,SKOV3细胞存活数量呈逐渐下降趋势(图3B),较0 μmol/L GW4869组相比,差异有统计学意义(P<0.01,P<0.05)。流式细胞术检测发现,随着GW4869的浓度增加,SKOV3细胞的凋亡率逐渐升高(图3C)。以上实验说明随着GW4869的浓度增高,SKOV3细胞外泌体释放水平明显降低,而其顺铂敏感性明显增强。
2.4 外泌体释放水平对卵巢癌细胞系SKOV3增殖与凋亡无影响
为了进一步排除外泌体抑制剂GW4869对于细胞增殖与凋亡的影响,我们进行了CCK-8与流式细胞术检测。我们按照0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L设置GW4869浓度梯度,CCK-8检测结果发现,随着GW4869浓度增加,SKOV3细胞增殖情况无明显差异(图4A),说明加入GW4869不影响SKOV3细胞的增殖。流式细胞术检测结果发现,随着GW4869浓度的增加,SKOV3细胞的凋亡率无明显差异(图4B),说明GW4869不影响SKOV3细胞的凋亡。
2.5 GW4869对外泌体形态及粒径分布无影响
为了检测外泌体抑制剂GW4869是否影响卵巢癌细胞系SKOV3的外泌体形态与粒径分布,我们进行了透射电镜和NTA检测。通过透射电镜检测发现,卵巢癌细 胞系SKOV3中对照组(NC)与GW4869组外泌体形态并没有明显改变(图5A),说明GW4869不影响SKOV3细胞外泌体的形态。通过NTA检测可以看出,对照组与GW4869组的外泌体粒径分布无明显差异(图5B),说明GW4869不影响SKOV3细胞外泌体的粒径分布范围。
2.6 卵巢癌细胞系SKOV3外泌体释放水平影响顺 铂外排量
为了进一步探究卵巢癌细胞外泌体释放水平影响其顺铂敏感性的主要机制,我们按照0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L设置GW4869浓度梯度处理SKOV3细胞,并用顺铂处理细胞,通过电感耦合等离子体质谱计检测外泌体中顺铂含量,随着外泌体抑制剂GW4869浓度的增加,卵巢癌细胞系SKOV3释放的外泌体中顺铂含量随之减少(图6A),而细胞内顺铂含量随之增加(图6B),较0 μmol/L组相比,差异有统计学意义(P<0.01)。说明卵巢癌细胞可通过外泌体分泌的形式外排一部分顺铂,从而降低细胞内顺铂药物浓度,进而降低卵巢癌细胞对于顺铂的敏感性 。
图3 卵巢癌细胞外泌体释放水平影响其对顺铂的敏感性
图4 外泌体释放水平对卵巢癌细胞增殖与凋亡的影响
图5 GW4869对外泌体形态及粒径分布的影响
图6 卵巢癌细胞外泌体释放水平影响顺铂外排量
3 讨论
卵巢癌作为女性生殖系统中常见的恶性肿瘤之一,由于发病隐匿且早期症状不明显,很多患者确诊时已为晚期,目前针对卵巢癌的有效治疗手段为手术治疗联合以铂类药物为基础的化疗,但由于肿瘤细胞对于铂类药物产生获得性耐药,致使晚期卵巢癌患者5年生存率仅为30%[12]。肿瘤耐药机制主要有以下几个方面:①化疗药物外排增多[13];②肿瘤细胞内特异性蛋白表达异常[2,14];③DNA损伤与修复的机制异常等[15-16]。研究表明由于化疗药物外排增多所导致的肿瘤耐药相比于其他耐药机制更为直接,而外泌体在这一过程中的作用尤为重要[13]。
外泌体是一类直径在30~150 nm具有完整膜结构的分泌型小体,可稳定转运蛋白质、化学物质、微小 RNA(microRNA,miRNA)、mRNA、DNA等多种物质,通过旁分泌或随体液循环完成细胞之间的信息交流,在多种疾病的发生发展中发挥关键作用。研究表明,外泌体参与肿瘤微环境的信息交流与物质交换,并能够作为多种肿瘤的诊断指标[17]。此外,肿瘤细胞相比于正常细胞可释放出更多的外泌体,并能够促进肿瘤增殖[18-19]、耐药形成[20]及转移发生[21]等。肿瘤相关的脂肪细胞和纤维母细胞通过外泌体将miR-21转运至附近的肿瘤细胞并通过下调凋亡相关蛋白增强细胞对紫杉醇的耐受。CROW等人[22]研究发现,外泌体参与上皮性卵巢癌细胞A2780的顺铂耐药过程。FORNARI等人[23]研究发现,肝细胞来源的外泌体含有miR-221能通过调节Caspase-3和抑制细胞凋亡来诱导索拉菲尼抵抗。外泌体不仅能够通过转运调控物质影响肿瘤细胞对化疗药物的耐受性,还能通过增加化疗药物而影响对细胞的损伤。DORAYAPPAN等[13]研究发现,化疗后耐药组病人血清中的外泌体数量明显多于敏感组病人,缺氧处理卵巢癌细胞后外泌体介导的顺铂外排增多,但缺少顺铂外排增多引起化疗耐药具体机制的相关研究。本课题发现,在卵巢癌细胞SKOV3中,外泌体能够携带一部分顺铂外排,从而使细胞内药物含量减少,从而使卵巢癌细胞SKOV3对于顺铂敏感性减弱,产生化疗耐药。
为了进一步探究外泌体在卵巢癌细胞SKOV3中化疗耐药过程中发挥的作用,我们使用外泌体抑制剂GW4869抑制外泌体释放。GW4869是一种中性鞘磷脂酶抑制剂,也是抑制外泌体释放应用最广泛的药物[24],研究表明,GW4869能够抑制神经酰胺介导的多泡体出芽以及外泌体释放[25-26],并且研究发现GW4869可以通过抑制外泌体释放而产生肿瘤化疗耐药:在胰腺癌中,GW4869能够减少肿瘤相关成纤维细胞外泌体的分泌,从而降低肿瘤对于吉西他滨的化疗耐药[27];在鼻咽癌中,GW4869能够抑制人类微血管内皮细胞介导的上皮-间充质转化从而降低肿瘤对于多柔比星的化疗耐药[28];在口腔鳞状细胞癌中,GW4869能够抑制含有miR-21的外泌体释放进而产生顺铂耐药[29]。目前尚无相关研究证实GW4869是否影响外泌体携带化疗药物外排从而影响肿瘤对于化疗药物的敏感性。本课题研究发现,在一定范围内,随着GW4869的剂量增加,其对外泌体的释放抑制程度也随之增强,说明GW4869能够有效抑制外泌体分泌,并且这种抑制作用呈浓度依赖性。进一步用化疗药物顺铂处理卵巢癌细胞系SKOV3,并同时设置不同浓度梯度的GW4869,发现随着GW4869浓度的增加,卵巢癌细胞SKOV3对于化疗药物顺铂的敏感性逐渐增强,质谱检测发现外泌体中携带的顺铂含量随之降低,证明GW4869能够抑制外泌体释放进而抑制肿瘤细胞通过外泌体外排化疗药物,这种抑制作用呈浓度依赖性。
综上所述,卵巢癌细胞所分泌的外泌体能够携带一部分顺铂外排,并且随着这种外排量的减少,卵巢癌细胞对于顺铂的敏感性逐渐增强,因此抑制卵巢癌细胞外泌体分泌可增强卵巢癌细胞对于化疗药物顺铂的敏感性,对于增强化疗药物的治疗效果具有潜在价值。
参考文献
[1] GONZÁLEZ-MARTIN A,POTHURI B,VERGOTE I,et al.Niraparib in patients with newly diagnosed advanced ovarian cancer[J].N Engl J Med,2019,381(25):2391-2402.
[2] WU H,LI R,ZHANG Z,et al.Kallistatin inhibits tumour progression and platinum resistance in high-grade serous ovarian cancer[J].J Ovarian Res,2019,12(1):125-133.
[3] LEE CK,ASHER R,FRIEDLANDER M,et al.Development and validation of a prognostic nomogram for overall survival in patients with platinum-resistant ovarian cancer treated with chemotherapy[J].Eur J Cancer,2019,117(3):99-106.
[4] ZHANG L,ZHANG X,FAN S,et al.Identification of modules and hub genes associated with platinum-based chemotherapy resistance and treatment response in ovarian cancer by weighted gene co-expression network analysis[J].Medicine(Baltimore),2019,98(44):e17083.
[5] KAWASHIMA N,YOSHIDA H,MIWA M,et al.MLH1 is a prognostic biomarker for serous ovarian cancer treated with platinum-and taxane-based chemotherapy[J].Anticancer Res,2019,39(10):5505-5513.
[6] NAKAMURA K,SAWADA K,KOBAYASHI M,et al.Role of the exosome in ovarian cancer progression and its potential as a therapeutic target[J].Cancers(Basel),2019,11(8):1147.
[7] WANG H,LU Z,ZHAO X.Tumorigenesis,diagnosis,and therapeutic potential of exosomes in liver cancer[J].J Hematol Oncol,2019,12(1):133.
[8] KULKARNI B,KIRAVE P,GONDALIYA P,et al.Exosomal miRNA in chemoresistance,immune evasion,metastasis and progression of cancer[J].Drug Discov Today,2019,24(10):2058-2067.
[9] KALLURI R,LEBLEU VS.The biology,function,and biomedical applications of exosomes[J].Science,2020,367(6478):6977.
[10] HE Z,LI W,ZHENG T,et al.Human umbilical cord mesenchymal stem cells-derived exosomes deliver microRNA-375 to downregulate ENAH and thus retard esophageal squamous cell carcinoma progression[J].J Exp Clin Cancer Res,2020,39(1):140.
[11] ZHAN Q,YI K,QI H,et al.Engineering blood exosomes for tumor-targeting efficient gene/chemo combination therapy[J].Theranostics,2020,10(17):7889-7905.
[12] QI X,YU C,WANG Y,et al.Network vulnerability-based and knowledge-guided identification of microRNA biomarkers indicating platinum resistance in high-grade serous ovarian cancer[J].Clin Transl Med,2019,8(1):28.
[13] DORAYAPPAN K,WANNER R,WALLBILLICH JJ,et al.Hypoxia-induced exosomes contribute to a more aggressive and chemoresistant ovarian cancer phenotype:a novel mechanism linking STAT3/Rab proteins[J].Oncogene,2018,37(28):3806-3821.
[14] DIAZ OSTERMAN CJ,OZMADENCI D,KLEINSCHMIDT EG,et al.FAK activity sustains intrinsic and acquired ovarian cancer resistance to platinum chemotherapy[J].Elife,2019,8(4):e47327.
[15] ZHAO J.Cancer stem cells and chemoresistance:The smartest survives the raid[J].Pharmacol Ther,2016,160(2):145-158.
[16] YU T,GUO F,YU Y,et al.Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy[J].Cell,2017,170(3):548-563.
[17] ZHANG L,YU D.Exosomes in cancer development,metastasis,and immunity[J].Biochim Biophys Acta Rev Cancer,2019,1871(2):455-468.
[18] MILANE L,SINGH A,MATTHEOLABAKIS G,et al.Exosome mediated communication within the tumor microenvironment[J].J Control Release,2015,219(4):278-294.
[19] HONG BS,CHO JH,KIM H,et al.Colorectal cancer cell-derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells[J].BMC Genomics,2009,10(2):556.
[20] MASHOURI L,YOUSEFI H,AREF AR,et al.Exosomes:composition,biogenesis,and mechanisms in cancer metastasis and drug resistance[J].Mol Cancer,2019,18(1):75.
[21] SYN N,WANG L,SETHI G,et al.Exosome-mediated metastasis:From epithelial-mesenchymal transition to escape from immunosurveillance[J].Trends Pharmacol Sci,2016,37(7):606-617.
[22] CROW J,ATAY S,BANSKOTA S,et al.Exosomes as mediators of platinum resistance in ovarian cancer[J].Oncotarget,2017,8(7):11917-11936.
[23] FORNARI F,POLLUTRI D,PATRIZI C,et al.In hepatocellular carcinoma miR-221 modulates sorafenib resistance through inhibition of Caspase-3-mediated apoptosis[J].Clin Cancer Res,2017,23(14):3953-3965.
[24] KULSHRESHTHA A,AHMAD T,AGRAWAL A,et al.Proinflammatory role of epithelial cell-derived exosomes in allergic airway inflammation[J].J Allergy Clin Immunol,2013,131(4):1194-1203.
[25] WANG X,HUANG W,LIU G,et al.Cardiomyocytes mediate anti-angiogenesis in type 2 diabetic rats through the exosomal transfer of miR-320 into endothelial cells[J].J Mol Cell Cardiol,2014,74(1):139-150.
[26] ZHAO M,DAI W,WANG H,et al.Periodontal ligament fibroblasts regulate osteoblasts by exosome secretion induced by inflammatory stimuli[J].Arch Oral Biol,2019,105(3):27-34.
[27] RICHARDS KE,ZELENIAK AE,FISHEL ML,et al.Cancer-associated fibroblast exosomes regulate survival and proliferation of pancreatic cancer cells[J].Oncogene,2017,36(13):1770-1778.
[28] HUANG L,HU C,CHAO H,et al.Drug-resistant endothelial cells facilitate progression,EMT and chemoresistance in nasopharyngeal carcinoma via exosomes[J].Cell Signal,2019,63(1):109385.
[29] LIU T,CHEN G,SUN D,et al.Exosomes containing miR-21 transfer the characteristic of cisplatin resistance by targeting PTEN and PDCD4 in oral squamous cell carcinoma[J].Acta Biochim Biophys Sin(Shanghai),2017,49(9):808-816.


