卡络磺钠减轻脓毒症大鼠急性肺损伤的效果及机制
作者:mac 来源:赛文期刊 日期:2021-05-14 08:46人气:
摘 要:目的 探讨卡络磺钠减轻脓毒症大鼠急性肺损伤(ALI)的效果及作用机制。方法 125只雄性Wistar大鼠随机分为假手术组,脓毒症组,卡络磺钠低剂量组(8 mg/kg),中剂量组(40 mg/kg),高剂量组(80 mg/kg),每组25只。另取大鼠20只,随机分为自噬抑制剂组(3-MA组)与卡络磺钠中剂量(40 mg/kg)组,每组10只。采用盲肠结扎穿孔(CLP)法建立脓毒症模型后,腹腔注射不同剂量的卡络磺钠或3-MA。绘制大鼠生存曲线;术后24 h行肺部Micro-CT检查;行动脉血气分析;测量大鼠肺系数及肺血管通透性;HE染色观察肺组织病理变化及评分;Western blotting法测定大鼠肺组织中LC3-Ⅱ/LC3-Ⅰ值水平。结果 与脓毒症组比较,各卡络磺钠组大鼠的生存率升高,动脉血氧分压及氧合指数增加,肺系数及肺血管通透性下降,差异有统计学意义(P<0.05)。肺影像学及肺HE染色显示,与脓毒症组比较,各卡络磺钠组大鼠肺组织病变及损伤程度减轻(P<0.05)。Western blotting结果显示,与假手术组比较,脓毒症大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值明显升高(5.1±2.7 vs. 2.7±0.7,P<0.05),与脓毒症组比较,卡络磺钠低、中剂量组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值明显升高(6.8±2.6、8.9±1.4 vs. 5.1±2.7),差异有统计学意义(P<0.05)。与卡络磺钠中剂量组比较,3-MA组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值明显降低(3.1±1.7 vs. 8.7±1.6),差异有统计学意义(P<0.05)。结论 卡络磺钠能减轻脓毒症大鼠肺损伤,其机制与其上调肺组织自噬水平有关。
关键词:脓毒症; 肺损伤; 卡络磺钠; 自噬;
The effect and mechanism of carbazochrome sodium sulfonate in reducing acute lung injury in rats with sepsis
Wang Jiao Zhang Xiu-Long Wang Jia-Xing Fu He-Peng Zhang Yu-Xiang
Graduate School of Hebei North University Department of Respiratory Medicine, the First Affiliated Hospital of Hebei North College Department of Critical Care Medicine, the Eighth Medical Center of Chinese PLA General Hospital Department of Critical Care Medicine, Cangzhou Hospital of Integrated TCM-WM Hebei
Abstract:Objective To explore the effect and mechanism of carbazochrome sodium sulfonate on acute lung injury in septic rats. Methods 125 healthy male Wistar rats were randomly divided into sham group, sepsis group, low dose carbazochrome sodium sulfonate group (8 mg/kg), middle dose carbazochrome sodium sulfonate group (40 mg/kg), high dose carbazochrome sodium sulfonate group (80 mg/kg). Each group had 25 rats. In addition, 20 rats were randomly divided into the autophagy inhibition group (3-MA) and the middle dose carbazochrome sodium sulfonate (40 mg/kg) group, with 10 rats in each group. After the preparation of septic rats by cecal ligation and puncture (CLP),the different doses of carbazochrome sodium sulfonate or 3-MA were given by Intraperitoneal injection. The survival curve is drawn. After CLP 24 hours, the lung Micro-CT of those survival rats were examined. The arterial blood gas, pulmonary index and vascular permeability of lung tissue were measured. Pathological changes of lung tissues were observed by HE staining. The level of autophagic marker (LC3-Ⅱ/LC3-Ⅰ) of lung tissue was measured by Western blotting. Results Compared with sepsis group, the survival rate of the rats of carbazochrome sodium sulfonate groups increased, the arterial blood oxygen partial pressure and oxygenation index increased, the pulmonary index and vascular permeability decreased, and the difference was statistically significant (P<0.05). Both of Lung Micro-CT and HE staining showed that compared with sepsis group, the lung tissue lesions and damage of the rats in each carbazochrome sodium sulfonate group were alleviated (P<0.05).Western blotting showed that: the ratio of LC3-Ⅱ/LC3-Ⅰ in lung tissue of septic rats was higher than sham group (5.1±2.7 vs. 2.7±0.7,P<0.05), while the ratio of LC3-Ⅱ/LC3-Ⅰ in lung tissue in the low dose and middle dose carbazochrome sodium sulfonate groups was further increased than sepsis group (6.8±2.6, 8.9±1.4 vs. 5.1±2.7), and the difference was statistically significant (P<0.05). The value of LC3-Ⅱ/LC3-Ⅰ in the lung tissue of rats in the 3-MA group was significantly lower than that in the middle dose carbazochrome sodium sulfonate group (3.1±1.7 vs. 8.7±1.6), and the difference was statistically significant (P<0.05). Conclusion The mechanism by which carbazochrome sodium sulfonate alleviating lung injury is related to the up regulation of autophagy level in septic rats.
Keyword:sepsis; acute lung injury; carbazochrome sodium sulfonate; autophagy;
脓毒症的病理生理特征是感染引起的宿主体内失控性的炎症反应,可导致机体内组织及器官功能损伤,严重者可进展为多脏器功能衰竭(multiple organ failure,MOF)[1]。急性肺损伤(acute lung injury,ALI)及急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是脓毒症的主要并发症[2]。但目前对脓毒症肺损伤的机制及治疗方法尚不十分明确。自噬是由溶酶体介导的细胞对老化细胞器、病原体的吞噬降解过程,是一种重要的防御保护机制,在细胞老化、代谢、免疫、感染等方面起着重要作用[3]。研究发现,脓毒症大鼠肺组织自噬水平升高,而上调自噬可以减轻脓毒症大鼠的肺损伤[4,5,6]。近年来,尽管对脓毒症的治疗已经取得了长足的进步,但脓毒症仍然是危重患者病死率高的重要原因。卡络磺钠是一种肾上腺素缩氨脲与磺酸钠的复合物,主要通过提高毛细血管壁的弹性而降低血管通透性,增强血管损伤部位的回缩能力从而减轻出血或止血[7]。本研究观察卡络磺钠对脓毒症大鼠肺形态学、影像学、血氧交换功能、血管通透性改变及自噬水平的影响,并初步探讨其作用机制,为脓毒症肺损伤的救治提供新思路。
1 材料与方法
1.1 材料
健康清洁级雄性Wistar大鼠145只,体重220~240 g,购自斯贝福(北京)生物技术有限公司,注射用卡络磺钠(20 mg/支,武汉华龙生物制药有限公司),自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)及伊文氏蓝均购自美国Sigma公司,Micro-CT(德国西门子公司,中国医学科学院动物所影像平台提供),GEM PREMIER 4000血气分析仪(美国Werfen公司),兔抗大鼠LC3B的多克隆抗体(美国CST公司),辣根过氧化物酶标记的山羊抗兔多克隆抗体(购自北京中杉生物技术有限公司),Nikon & Spot图像采集处理系统(日本Nikon公司),凝胶成像系统(美国Bio-Red公司)。其他试剂均为国产分析纯。
1.2 方法
1.2.1 脓毒症大鼠模型制备及实验分组
选取125只大鼠,采用随机数字表法分为:假手术组、脓毒症组、卡络磺钠低剂量(8 mg/kg)组、卡络磺钠中剂量(40 mg/kg)组、卡络磺钠高剂量(80 mg/kg)组,每组25只。按照文献[8]中的方法对大鼠行盲肠结扎穿孔,构建严重腹腔感染致脓毒症模型:动物术前称重、编号,禁食12 h,自由饮水。用3%戊巴比妥40 mg/kg行腹腔注射麻醉。大鼠麻醉后固定,沿腹中线做一长约1.5 cm的切口,逐层切开,暴露直肠并小心游离其盲肠盲端,在距盲端1 cm处结扎,用18号针头贯穿2次,挤出少量肠内容物,并留置一条2 mm宽的橡皮条贯通盲肠,防止针孔闭合。然后将盲肠小心移入腹腔,逐层缝合腹壁切口。术后动物可自由活动及饮水。假手术组只开腹翻动肠管后关腹,不结扎及穿孔盲肠。卡络磺钠低、中、高剂量组分别于术后0.5h、8 h及16 h后于大鼠腹膜内注射不同剂量(8、40、80 mg/kg)的卡络磺钠。假手术组与脓毒症组大鼠于同时间点给予腹腔注射等量生理盐水。
1.2.2 大鼠术后生存率观察
假手术组、脓毒症组、卡络磺钠低、中、高剂量组随机取15只大鼠,分别于术后6、12、24、36、48、72 h观察其生存情况,计算各组生存率。
1.2.3 大鼠动脉血气测定
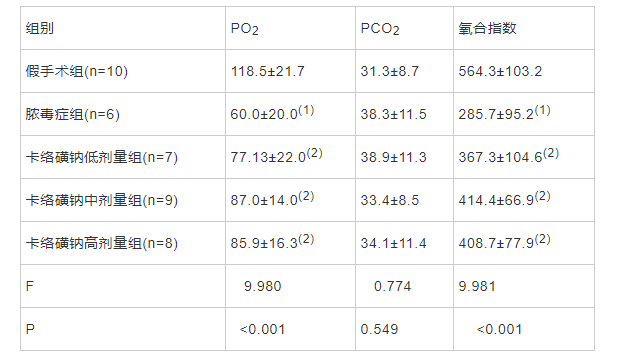
每组随机取10只用于检测卡络磺钠对脓毒症大鼠肺损伤肺形态学及功能的影响。术后24h,假手术组、脓毒症组、卡络磺钠低、中、高剂量组各存活10、6、7、9、8只,麻醉大鼠,用肝素抗凝的1 mL动脉血气针经腹主动脉采集0.5 mL血,采用PREMIER 4000动脉血血气分析仪测定氧分压(PO2)、二氧化碳分压(PCO2),计算氧合指数。
1.2.4 大鼠肺部Micro-CT检测
术后24 h麻醉大鼠后,利用Micro-CT仪观察大鼠肺部影像学特点,测量参数:摄片时间120 s,电压90 kV,电流160 μA,照片像素40 μm,重建后图片像素大小1024×1024。
1.2.5 大鼠肺系数检测
采用颈部脱臼法将各组存活大鼠处死,取大鼠双侧肺,吸干肺表面水分,计算肺系数(LW/BW)=肺湿重(mg)/大鼠体重(g)。
1.2.6 大鼠肺组织病理学观察及评分
剪取各组大鼠右肺下叶组织小块,浸入4%多聚甲醛内固定,梯度乙醇脱水,常规石蜡包埋、切片(5 μm),HE染色,光镜下观察肺组织病理学变化。在200倍光镜下任意选取10个视野,参照Hong等[9]标准进行肺组织病理损伤计分。DM4000B光学显微镜(×200)观察病理学结果,进行病理学评分,评分项目包括肺泡腔充血、中性粒细胞浸润、纤维蛋白渗出、肺泡间隔增宽,每项按损伤程度评为0、1、2及3分,分别为无损伤、轻度损伤、中度及重度损伤,取其平均值。
1.2.7 大鼠肺组织通透性检测
采用伊文氏蓝(EB)染料渗出技术[10]检测大鼠肺组织通透性。将溶于生理盐水的EB以2 mL/kg自大鼠尾静脉注射,用PBS(10 mL)冲洗肺循环;取右下肺叶约0.2 g,浸泡在2 mL甲酰胺溶液 (1 mL/100 mg中),与甲酰胺在60 ℃条件下共孵化16 h,待肺组织中色素全部萃取后,取出组织,7000 ×g离心10 min,取上清液,测量吸光度(OD620)值,计算组织中的EB含量,以此表示肺血管通透性。
1.2.8 Western blotting法测定大鼠肺组织LC3蛋白表达量
由于卡络磺钠中、高剂量组之间大鼠肺组织改变无明显差异,因此只测定假手术组、脓毒症组、卡络磺钠低剂量组、卡络磺钠中剂量组大鼠肺组织中LC3的表达。将100 μg大鼠肺组织裂解液进行SDS-PAGE电泳,电转至PVDF膜,脱脂奶粉封闭。一抗为兔抗大鼠LC3多克隆抗体(1︰800,美国CST公司)。二抗为辣根过氧化物酶标记的山羊抗兔IgG(1:5000,北京中杉生物技术有限公司),增强化学发光法显色。以GAPDH为内参照。以特异性LC3与对应GAPDH蛋白条带光密度值的比值LC3-Ⅱ/LC3-Ⅰ为LC3蛋白表达量。
1.2.9 3-MA对大鼠肺组织自噬水平的影响
为探讨卡络磺钠干预机制与自噬的关系,另取大鼠20只,随机分为自噬抑制剂组(3-MA组)与卡络磺钠中剂量(40 mg/kg)组,每组10只。卡络磺钠中剂量组分别于术后0.5h、8 h及16 h于大鼠腹膜内注射40 mg/kg卡络磺钠,3-MA组于术后即刻腹腔内注射15 mg/kg 3-MA,术后0.5 h、8 h及16 h予40 mg/kg卡络磺钠干预。按1.2.3、1.2.6和1.2.8中的方法检测大鼠肺组织氧合功能,组织病理学及LC3蛋白的表达。
1.3 统计学处理
采用SPSS 18.0软件进行统计分析。数据符合正态分布,以`x±s表示,多组间比较采用单因素方差分析,进一步组间两两比较用SNK-q检验;两组间比较采用t检验。采用Kaplan-Meier法分析生存率。P<0.05为差异有统计学意义。
2 结果
2.1 卡络磺钠对脓毒症大鼠生存率的影响
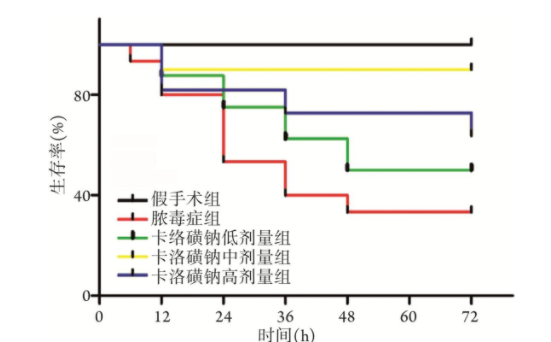
各卡络磺钠组大鼠生存率均高于脓毒症组,卡络磺钠中剂量及高剂量组大鼠生存率高于低剂量组,差异有统计学意义(P<0.05),卡络磺钠中剂量与高剂量组大鼠生存率差异无统计学意义(P>0.05,图1)。
图1 各组大鼠生存率比较(n=15)
2.2 卡络磺钠对脓毒症大鼠肺氧合功能的影响
脓毒症组大鼠动脉血PO2及氧合指数低于正常对照组,各卡络磺钠组大鼠动脉血PO2及氧合指数均高于脓毒症组,差异有统计学意义(P<0.01);各卡络磺钠组间大鼠动脉血PO2及氧合指数差异无统计学意义(P>0.05)。各组大鼠动脉血PCO2差异无统计学意义(P>0.05,表1)。
表1 各组大鼠动脉血PO2、PCO2及氧合指数比较 (mmHg,`x±s)
2.3 卡络磺钠对脓毒症大鼠肺影像学的影响
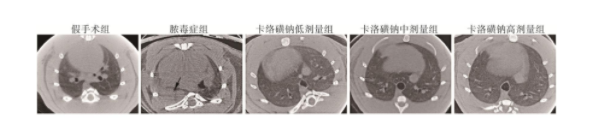
Micro-CT结果显示,脓毒症大鼠双肺见斑片状渗出,严重可发生肺不张及肺实变(图2,黑色箭头示)。给予卡络磺钠干预后,大鼠双肺斑片渗出明显减少,未见明显的肺不张及肺实变;且随着药物剂量的增加,大鼠肺部炎症表现逐渐减轻(图2)。
图2 各组大鼠肺Micro-CT结果
2.4 卡络磺钠对脓毒症大鼠肺水肿的影响
肉眼观察见假手术组大鼠肺组织表面光滑、干燥,红白相间;脓毒症大鼠肺组织肿胀明显,表面呈暗红色,且液体渗出较多。与脓毒症大鼠比较,卡络磺钠组大鼠肺组织肿胀减轻,表面逐渐恢复至红白相间,且肺表面液体渗出逐渐减少(图3)。肺系数结果显示,与假手术组比较,脓毒症组大鼠肺系数明显增加,而卡络磺钠中、高剂量组大鼠的肺系数与脓毒症组比较明显降低,差异有统计学意义(P<0.05,表2)。
图3 各组大鼠肺组织标本肉眼观图示

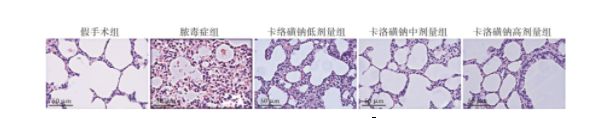
2.5 卡络磺钠对脓毒症大鼠肺组织学的影响
HE染色结果显示,假手术组大鼠肺组织肺泡壁光滑,肺泡腔无渗出且结构清晰完整。脓毒症组大鼠肺组织肺泡腔出现大量红细胞、炎性细胞及血浆样物质渗出,肺泡间隔及肺泡壁明显增厚不均,部分肺泡腔塌陷。各卡络磺钠组大鼠肺部均呈一定程度的组织水肿、炎性浸润,但严重程度均不及脓毒症组;中、高剂量组大鼠肺组织的炎症改变程度较低剂量组进一步减轻(图4)。与假手术组比较,脓毒症组大鼠肺病理学评分明显升高,各卡络磺钠组大鼠肺病理学评分均低于脓毒症组,且卡络磺钠中、高剂量组大鼠肺病理学评分低于低剂量组,差异有统计学意义(P<0.05,表2)。
2.6 卡络磺钠对脓毒症大鼠肺血管通透性的影响
与假手术组比较,脓毒症大鼠肺血管通透性增加,各卡络磺钠组大鼠的肺血管通透性均低于脓毒症组,且卡络磺钠中、高剂量组大鼠肺组织的通透性低于低剂量组,差异有统计学意义(P<0.05,表2)。
表2 各组大鼠肺组织的特征表现
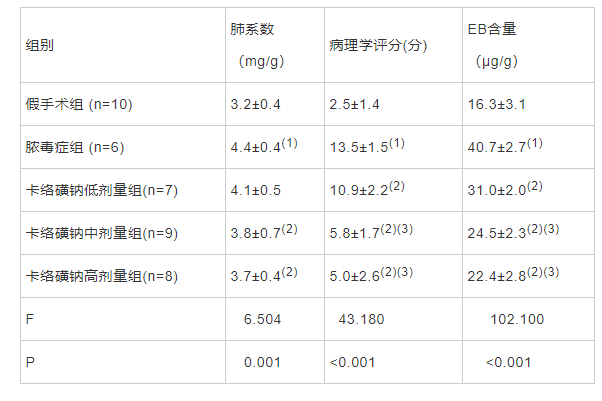
图4 各组大鼠肺组织病理学表现
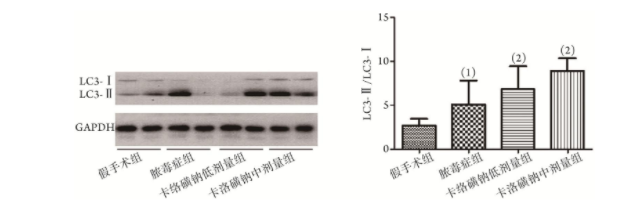
2.7 卡络磺钠对脓毒症大鼠肺组织自噬水平的作用
与假手术组比较,脓毒症大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值明显升高(5.1±2.7 vs. 2.7±0.7),卡络磺钠低、中剂量组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值高于脓毒症组(6.8±2.6、8.9±1.4 vs. 5.1±2.7),差异有统计学意义(P<0.05,图5)。
图5 卡络磺钠对脓毒症大鼠肺组织自噬水平的影响
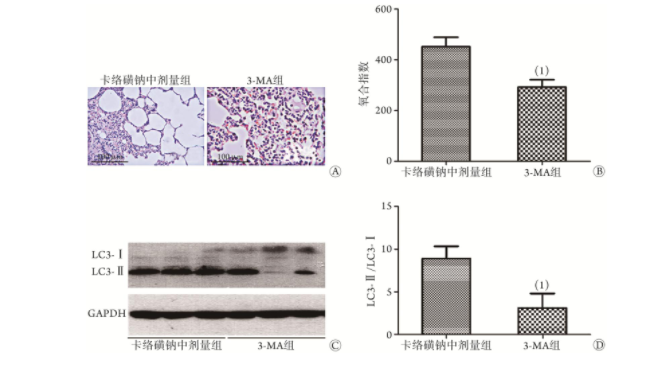
2.8 3-MA对卡络磺钠中剂量组大鼠肺组织氧合功能、组织学及自噬水平的影响
与卡络磺钠中剂量组比较,3-MA组大鼠肺组织病理损伤加重(图6A),氧合指数下降[(451.9±104.0)mmHg vs. (292.3±82.1)mmHg],差异有统计学意义(P<0.05,图6B)。与卡络磺钠中剂量组比较,3-MA组大鼠肺组织LC3-Ⅱ/LC3-Ⅰ值明显降低(3.1±1.7 vs. 8.7±1.6),差异有统计学意义(P<0.05,图6C、D)。
图6 3-MA对卡络磺钠中剂量组大鼠肺组织氧合功能、组织学及自噬水平的影响3 讨 论
卡络磺钠是一种毛细血管稳定剂,已被广泛用于治疗因毛细血管脆弱性引发的出血,也可作用于多个脏器(如牙周、关节腔、膀胱、前列腺等器官或组织)发生病变时的血管高通透性,从而达到保护器官功能的作用[11,12,13,14]。有研究发现卡络磺钠可以抑制肺血管通透性的增加,减轻由碘克沙酸诱导的动脉血PO2降低[15]。本研究发现,卡络磺钠可提高脓毒症大鼠生存率,对脓毒症肺损伤具有保护作用,且具有剂量依赖性。研究还发现,卡络磺钠能明显降低大鼠肺组织EB含量,使动脉血PO2及氧合指数明显提升,肺系数降低,提示卡络磺钠干预起到了降低脓毒症引起的肺血管通透性增加,减轻组织液渗漏,降低肺水含量,改善肺氧合功能的作用,与上述研究一致。进一步研究发现,与脓毒症组比较,卡络磺钠组大鼠肺影像学及病理切片结果中炎症浸润减少,血浆样渗出减轻,病理评分明显降低,中剂量组的效果明显优于低剂量组,证实应用卡络磺钠治疗能减轻脓毒症大鼠的肺损伤,并改善脓毒症大鼠ALI的特征性改变。
自噬是将体内受损的细胞器或蛋白分子通过溶酶体进行自我吞噬及自我降解的过程。通过自噬细胞可以降解自身不需要的成分,循环利用氨基酸及其他可以被重新利用的物质,且有利于维持细胞的稳定[16]。自噬的改变与肺部疾病相关,尤其在慢性阻塞性肺疾病、肺动脉高压、肺纤维化、炎症性肺损伤、ARDS及结核的发生发展中起重要作用,可能为相关疾病的干预靶点[17,18,19]。以往多项研究发现自噬参与脓毒症肺损伤的内源性保护机制[4,5,6,20]。本实验通过测定LC3的蛋白表达量即LC3-Ⅱ与LC3-Ⅰ的比值来表达自噬程度。LC3是哺乳动物细胞中酵母自噬相关基因8(autophagy-related gene 8,ATG8)的同源物,定位于前自噬泡及自噬泡膜表面,是参与自噬体形成的重要基因。自噬未启动时,LC3以可溶性的LC3-Ⅰ形态常规表达于细胞表面;当自噬发生时,脂质衍生物磷脂酰乙醇胺与LC3-Ⅰ结合形成LC3-Ⅱ,LC3-Ⅱ是自噬水平高低的重要分子标志物,与自噬泡数量呈正比[18]。本研究通过Western blotting检测了脓毒症急性肺损伤时自噬标志蛋白LC3的表达情况以及卡络磺钠干预对其的影响,结果发现脓毒症肺损伤大鼠肺组织中LC3-Ⅱ表达增高,LC3-Ⅱ/LC3-Ⅰ比值明显高于假手术组,提示脓毒症急性肺损伤时自噬水平增加;卡络磺钠干预使肺组织的自噬水平增高,LC3-Ⅱ/LC3-Ⅰ比值较脓毒症组增高,且具有一定的剂量依赖性,中剂量组的效果优于低剂量组,表明卡络磺钠可上调大鼠肺组织的自噬水平。本研究结果还显示3-MA组的LC3-Ⅱ/LC3-Ⅰ水平显著低于卡络磺钠中剂量组,且3-MA组大鼠肺通透性及组织学改变明显加重,提示卡络磺钠的肺保护作用可被自噬抑制剂3-MA减弱。
综上所述,卡络磺钠可能通过减轻血管渗漏、上调肺组织中的自噬水平而对脓毒症的ALI产生保护作用,且该保护作用具有一定的剂量依赖性。卡络磺钠上调肺组织自噬水平的机制尚不清楚,未来仍需要进一步探讨卡络磺钠的作用机制,并进行临床试验,以期为临床防治脓毒症肺损伤提供理论依据。
参考文献
[1] Sterling SA, Puskarich MA, Glass AF, et al. The impact of the Sepsis-3 septic shock definition on previously defined septic shock patients[J]. Crit Care Med, 2017, 45(9): 1436-1442.
[2] De Freitas Caires N, Gaudet A, Portier L, et al. Endocan, sepsis, pneumonia, and acute respiratory distress syndrome[J]. Crit Care, 2018, 22(1): 280.
[3] Pereira G, Leao A, Erustes A G, et al. Pharmacological Modulators of Autophagy as a Potential Strategy for the Treatment of COVID-19[J]. Int J Mol Sci, 2021, 22(8).
[4] Dong AL, Wang L, Wang YY, et al. Role of autophagy in hydrogen-induced reduction of lung injury in septic mice[J].Chin J Anesthesiol, 2017, 37(5):632-636.[董艾莉, 王露, 王妍妍,等. 自噬在氢减轻脓毒症小鼠肺损伤中的作用[J]. 中华麻醉学杂志, 2017, 37(5):632-636.]
[5] Mannam P, Shinn AS, Srivastava A, et al. MKK3 regulates mitochondrial biogenesis and mitophagy in sepsis-induced lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(7): 604-619.
[6] Wang ZX, Li Y, Yang XW, et al. Protective effects of rapamycin induced autophagy on CLP septic mice[J]. Comp Immunol Microbiol Infect Dis, 2019, 64: 47-52.
[7] Lu XJ, Chen F, Wang Y, et al.Primary investigation on clinical effect of carbazochrome sodium sulfonate and sodium chloride injection on neurogenic pulmonary edema in severe cerebrovascular disease patients[J].Journal of Capital Medical University, 2020, 41(3): 470-474.[陆晓炯, 陈峰, 王英, 等. 卡络磺钠氯化钠注射液对重症脑血管病合并神经源性肺水肿治疗效果初探[J]. 首都医科大学学报. 2020, 41(3): 470-474.]
[8] Nie WL, Wang XD, Zhang YX. Regulatory effect of ulinastatin on Treg and Th17 cells of rats in late stage of sepsis[J]. Med J Chin PLA, 2015,40(11):892-896.[聂文龙, 王晓丹, 张玉想. 乌司他丁对脓毒症晚期大鼠Treg和Th17细胞的调节作用[J]. 解放军医学杂志. 2015, 40(11): 892-896.]
[9] Hong SB, Koh Y, Lee IC, et al. Induced hypothermia as a new approach to lung rest for the acutely injured lung[J]. Crit Care Med, 2005, 33(9): 2049-2055.
[10] Sendo T, Kataoka Y, Takeda Y, et al. Nitric oxide protects against contrast media-increased pulmonary vascular permeability in rats[J]. Invest Radiol, 2000, 35(8): 472-478.
[11] Hong JY, Lee JS, Choi SH, et al. A randomized, double-blind, placebo-controlled multicenter study for evaluating the effects of fixed-dose combinations of vitamin C, vitamin E, lysozyme, and carbazochrome on gingival inflammation in chronic periodontitis patients[J]. BMC Oral Health, 2019, 19(1): 40.
[12] Luo Y, Zhao X, Releken Y, et al. Hemostatic and anti-inflammatory effects of carbazochrome sodium sulfonate in patients undergoing total knee arthroplasty: a randomized controlled trial[J]. J Arthroplasty, 2020, 35(1): 61-68.
[13] Sugaya K, Nishijima S, Kadekawa K, et al. Pelvic venous congestion induces lower urinary tract dysfunction in rats[J]. Biomed Res, 2018, 39(6): 269-277.
[14] Lyu ZX, Wu JT, Jiang J, et al. Effect of tranexamic acid combined with carbazochrome sodium sulfonate on blood loss and safety after total knee arthroplasty[J]. Chin J Tissue Engineering Res, 2021, 25(3): 386-390. [吕泽祥, 吴居泰, 蒋健, 等. 氨甲环酸联合卡络磺钠干预全膝关节置换的失血及安全性[J]. 中国组织工程研究, 2021, 25(3): 386-390.]
[15] Sendo T, Goromaru T, Aki K, et al. Carbazochrome attenuates pulmonary dysfunction induced by a radiographic contrast medium in rats[J]. Eur J Pharmacol, 2002, 450(2): 203-208.
[16] Mizushima N, Levine B. Autophagy in human diseases[J]. N Engl J Med, 2020, 383(16): 1564-1576.
[17] Mizumura K, Cloonan S, Choi ME, et al. Autophagy: friend or foe in lung disease?[J]. Ann Am Thorac Soc, 2016, 13(Suppl 1): 40-47.
[18] Mizumura K, Cloonan SM, Haspel JA, et al. The emerging importance of autophagy in pulmonary diseases[J]. Chest, 2012, 142(5): 1289-1299.
[19] Wang K, Chen Y, Zhang PJ, et al. Protective features of autophagy in pulmonary infection and inflammatory diseases[J]. Cells, 2019, 8(2): 123.
[20] Liao S, Sun P, Gu Y, et al. Autophagy and pulmonary disease[J]. Ther Adv Respir Dis, 2019, 13:1-13.
上一篇:建立具有同质化管理特点的智能药学门诊初探
下一篇:肺结节多学科联合诊治价值
下一篇:肺结节多学科联合诊治价值


