中美儿科临床试验管理的比较研究
作者:mac 来源:文阅期刊网 日期:2021-08-23 08:38人气:
摘 要:儿科临床试验是指在0~18岁人群中进行药物的系统性研究,儿童作为临床试验的受试者,其试验过程的管理尤为重要,能否高质量地开展儿科临床试验直接影响到儿童用药的上市速度,进而影响到儿童用药的可及性。目前,我国儿科临床试验中尚存在受试者招募困难、试验过程缺乏高质量的规范管理以及在伦理审查把关上还不够严谨等问题。基于此,本文在综合分析美国促进儿科临床试验开展的政策措施及监管经验的基础上,对比我国儿科临床试验相关政策与监管体系,分析我国在儿科临床试验管理上存在的问题,以此提出改善我国儿科临床试验管理的对策建议。
关键词:儿童用药 临床试验 政策法规 监管
Comparative study on the management of pediatric clinical trials between China and America
ZHONG Yi-ming ZHANG Tian-yi GUO Wen
China National Pharmaceutical Industry Information Center, China State Institute of Pharmaceutical Industry;
Abstract:A pediatric clinical trial is a systematic study of a drug in people aged 0~18 years. Due to the specialness of the subjects, the process management of pediatric clinical trial is particularly important. Whether a high-quality pediatric clinical trial can be carried out directly affects the marketing speed of pediatric drugs, and then affects the accessibility of pediatric drugs. At present, there are still some problems in pediatric clinical trials in China, such as difficulty in recruiting subjects, lack of high-quality standard management in the trial process, and lack of rigor in the ethical review. Based on a comprehensive analysis of the policies, measures and regulatory experience in promoting the development of pediatric clinical trials in the United States, this paper compared the relevant policies and regulatory systems of pediatric clinical trials in China with those in the United States, and analyzed the problems existing in the management of pediatric clinical trials in China, so as to propose countermeasures and suggestions for improving our management of pediatric clinical trials.
Keyword:pediatric drugs; clinical trials; policies and regulations; regulatory;
新中国成立以来,国家高度重视儿童健康,在全社会的共同努力下,我国在保障儿童用药、促进儿童健康发展方面取得巨大进步,儿童的基本用药状况显著改善。然而,作为世界上人口基数最大的发展中国家,受整体社会发展水平、地区经济差异等因素影响,我国儿童用药保障任务依然艰巨。目前,我国儿童专用药缺乏的问题仍旧比较突出,根据国家药品监督管理局官网统计数据显示,截至2020年12月30日,国内具有批准文号的药品(包括进口批文号)共计165 186个,而儿童专用药的批文号仅有 3 580 个[1],占比约为2.2%,这相比于我国16.9%的儿童人口占比、12%的患病率[2]来说,还远远不够。我国儿童用药供不应求的原因在于儿童药物的研发投入不足、临床试验的开展难度较大。自20世纪80年代以来,为保障本国儿童用药,美国FDA采取了一系列管理措施来完善儿童用药监督管理体系。在儿科临床试验的管理上,美国走在世界的前列,其相关的管理经验对改善我国儿科临床试验现状、提升儿童用药可及性具有重要的借鉴意义。
1 中美儿科临床试验的开展现状
1.1 美国儿科临床试验的开展情况
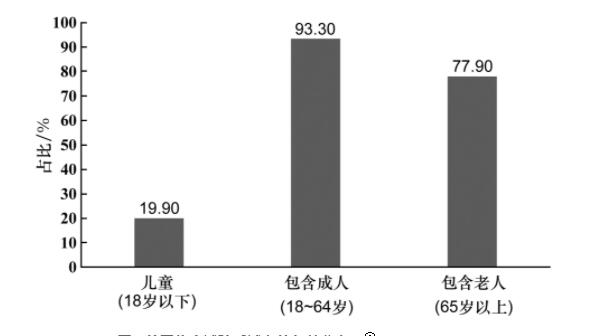
根据美国国立卫生研究院临床试验注册管理中心(clinicaltrials.gov)统计数据显示,截至2020年11月4日,美国共有136 444项临床研究登记,其中针对儿童(18岁以下)的临床试验有27 275项,占比约为19.9%;包含成人(18~64岁)的临床试验有127 281项, 占比约为93.3%(与其他年龄段如儿童有交叉部分);包含老人(65岁以上)的临床试验有106 286项,占比约为77.9%,见图1[3]。
图1 美国临床试验受试者的年龄分布
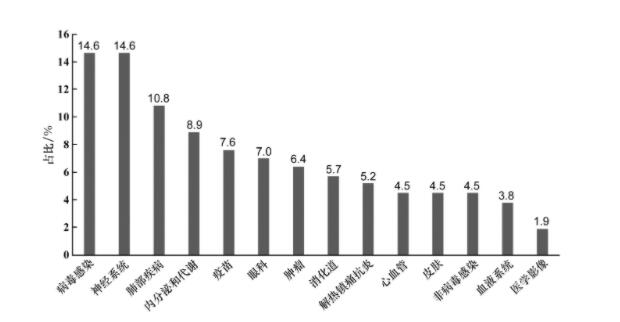
根据美国政府责任办公室(US Government Accountability Office, US GAO)发布报告的数据显示,近年来美国进行儿科临床试验的药物治疗领域较广,包括过敏和哮喘治疗药物,也包括严重疾病如肿瘤和HIV治疗[4],最多的是神经系统和抗病毒感染药物的儿科临床试验,见图2。
图2 美国儿科临床试验的治疗领域分布
1.2 我国儿科临床试验的开展情况
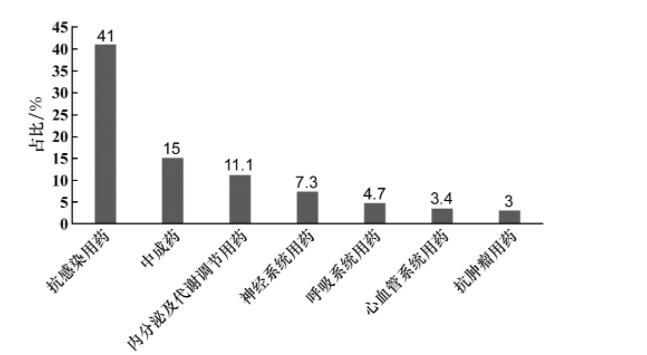
根据中国医药工业信息中心的统计数据显示,截至2020年10月16日,全国共有11 654条临床登记信息,其中涉及儿童年龄阶段的临床研究642项,占比约为5.5%;针对0~18岁儿童的临床试验共计234项,占比约为2.0%(涉及儿童的临床研究指受试人群包含儿童、成人;针对儿童的临床研究指受试人群仅为0~18岁儿童)。此外,从试验药物的类别来看,我国儿科临床试验药物类别分布相对集中,其中以抗感染用药、中成药以及内分泌及代谢调节用药为主,三者开展临床试验的件数占比分别为41.0%,15.0%和11.1%,见图3。在抗感染用药中,又以预防性疫苗的临床试验为主。
图3 我国儿科临床试验药物类别分布
1.3 中国和美国儿科临床试验开展情况对比
从开展的儿科临床试验项目数量来看,美国针对0~18岁年龄段的临床试验项目数有27 275项,而我国针对儿童年龄阶段的临床试验仅有234项,差距非常明显。从试验药物的类别来看,美国的儿科临床试验药物已经从传统的抗感染药、止咳平喘药等常见病领域,扩展到了神经系统和抗肿瘤用药领域。相比之下,我国目前还是以抗感染用药等常见病用药为主,而随着我国儿童疾病谱的变化,过去少见的血液系统疾病[5](主要是白血病)、恶性肿瘤[6]等不断增多,我国儿童药物的研发重心也需相应调整,与时俱进。
1.4 国内儿科临床试验面临的困境
2014年以来,我国针对儿童开展的临床试验约占同期临床试验总数的2.0%,这相对于我国16.9%的儿童人口占比和12%的患病率而言,国内儿科临床试验的开展数量还相当欠缺,我国儿科临床试验的开展主要面临以下三方面的困境。
1.4.1 缺乏鼓励和指导儿童药物研发的具体措施
与成人药相比,儿童药研发除了要求安全性、有效性以外,还对药品的外观、口感、辅料选择等方面有更高的要求[7],需要在研发各个环节投入较大人力、物力及时间成本,因此儿童药研发费用更高、难度更大、周期更长,这导致许多制药企业对儿童药品研发望而止步。我国目前虽然有宏观政策从大方向鼓励药品研发企业开展儿童用药的研发工作,但是缺少具体的优惠政策以及临床试验指导,未能有效激发企业研发能力。
1.4.2 儿童受试者招募困难
目前,我国对于临床试验的宣传教育还不够重视,社会公众对于药物临床试验的了解与接受程度存在个体化差异,学历较高的家长对临床试验和伦理委员会评审的了解相对较好,而学历较低的家长对临床试验的了解有限[8-9],同意儿童参与临床试验的积极性不高。此外,由于儿童药物临床试验涉及新生儿、婴儿、幼儿等多个生长发育阶段,其风险和复杂程度远高于成人试验,并且对临床研究人员的要求更高,往往需要具备儿童医学、药学、心理学、护理学、伦理学等方面知识和经验,而这类复合型人才又相对缺乏[10],这些都影响儿科临床试验的正常开展。
1.4.3 临床试验过程缺乏科学规范的管理
近年来,我国虽然放宽了临床试验的准入制度,临床试验的开展效率得以提升。然而目前我国对于药物临床试验过程还缺乏高质量的规范管理,尚存在部分伦理委员会对临床试验项目的审查较宽松,部分研究机构未对受试者购买保险以及在签署知情同意书时未充分告知受试者临床试验风险等问题[11]。试验过程缺乏科学规范的监督管理,不仅影响到药物临床试验的质量,同时也不利于保护受试者的权益。
2 美国儿科临床试验的管理举措
2.1 制定激励与强制相结合的政策
近20多年来美国通过立法逐步建立了较为完善的儿童用药管理制度。一方面,美国不断完善鼓励儿童药物研发的措施,1997年,美国FDA《食品药品管理现代化法案》[12]中出现的“儿科独占条款”对进行儿科研究的药物授予独占性或专利保护,即企业自愿进行儿科研究,完成研究并获得儿科人群相关数据后,可获得为期6个月的儿科市场独占权。2007年美国FDA推出罕见儿科疾病优先审评项目,奖励罕见儿童用药的开发,用于不符合优先审评的药物申请优先审评,使得药品审查周期从10个月缩短至6个月,进一步激发医药企业布局儿童用药研发[13]。另一方面,美国通过立法强制进行儿童药物研究,2003年颁布的《儿童研究公平法案》[14]强制要求企业除非经FDA同意准予豁免,在新药申请(new drug application, NDA)或生物制品上市许可申请(biologics license application, BLA)递交之前,必须提供儿科临床研究计划群体的安全性和有效性评价资料。《FDA安全与创新法案》[15]要求研究者应当在新药研制的早期阶段就递交儿童用药初期研究计划,使得在新药研发早期阶段考虑未来能否适用于儿童,并根据计划同步开展儿童用药试验。该法案同时授权《儿童最佳药品法案》[16]、《儿童研究公平法案》及《儿童医疗器械安全改进法案》[17],要求对药品和生物制品新有效成分、适应证、剂型、给药剂量或途径等提出新药申请或补充申请的,除非经FDA同意准予豁免,必须提供儿科群体的安全性和有效性评价资料,甚至要具体到每一年龄段儿童的给药剂量和途径数据资料。
2.2 成立专项儿科管理机构
为了保障儿童用药的安全合理,美国分别组织成立了3个专项儿科管理机构:儿科治疗办公室(Pediatric Treatment Office, PTO)、儿科评审委员会(Pediatric Review Committee, PeRC)和儿科咨询委员会(Pediatric Advisory Committee, PAC)。儿科治疗办公室是直接由美国国会授权,其核心任务是保证儿童能用到创新、安全且有效的药物,主要职责为:确保儿科临床试验设计的科学性与伦理方案的合理性、对获得儿科临床研究数据后修改的儿童用药标签进行安全性审查以及处理与国际交流相关的工作。儿科评审委员会是《食品药品监督管理局现代化法》规定必须成立的机构,其主要职责为:根据《儿童研究公平法案》的规定,对药品或生物制品的新药申请或补充申请中的儿科研究计划进行专业审评,并对儿科研究方案进行评估,以确保儿科研究的安全性和可行性。儿科咨询委员会的工作主要涉及以下两方面:① 确定与儿科治疗相关的药品或生物制品的临床试验设计分析及伦理道德。② 处理有关《儿童最佳药品法案》第3部分“药物研究科研基金”中指定的儿童标签纠纷,第5部分中指定的儿童标签修改以及第17部分“不良事件报告”中具有市场独占权的药品不良事件报告。3个机构各司其职相互协作,一起为儿童用药的临床试验和安全监管提供指导帮助。
2.3 重视临床试验监管体系的建设
美国FDA对于临床试验过程的监督管理非常系统化,基于风险管理的药物临床试验检查是FDA的主要考虑要点[18],FDA对临床试验监管体系的建设主要包含以下四方面。
2.3.1 完善法规体系的建设
要进行监管,首先要有法可依。FDA根据美国国会通过的相关法律,不断建立和完善了诸多与药物临床试验相关的法规,并公布在其网站上。目前在FDA网站上共汇总列出了24项与《药物临床试验质量管理规范》(GCP)和临床试验相关的法规,为其监管工作搭好框架。同时其网站上还公布了各项法规的历次增修订过程,包括法规增修订的背景、变化的内容、法规草案曾经接收并得到回复的意见以及最终是如何定稿的,从而使这些法规要求可以更为充分地被理解和接受[19]。
2.3.2 建立专业的监管队伍
美国FDA始终坚持“专家执法和执法人员专家化”,为了提升监管水平,FDA相继与马里兰大学、乔治城大学、加州大学洛杉矶分校等合作设立监管科学和创新卓越中心(CERSI),以促进转化毒理学、药物临床前安全性评估、真实世界临床研究等方面监管决策的发展[20-22]。
2.3.3 注重监管机构与药企的沟通交流
美国FDA和试验申办者之间会通过各种有效方式(如电话交谈、信件或会议)进行双向交流[23]。并且FDA会定期安排申请人和新药审评人员之间举行不同研发时期的交流会,探讨技术问题,解决审评过程中出现的疑难问题,通过多方面的互动交流对缩短新药开发周期、避免新药开发过程的资源浪费、缩短新药审批时间都起到很好的作用。
2.3.4 强调伦理委员会(Institutional Review Board, IRB)的独立性
在美国,IRB的组成和一切活动均在FDA监督下,不受临床试验组织和实施者的干预或影响[24]。IRB现场检查是FDA检查的重点,通常FDA需要1年的时间来完成,FDA对其实行常规检查和有因检查相结合的检查手段。
2.4 美国儿科临床试验管理取得的成效
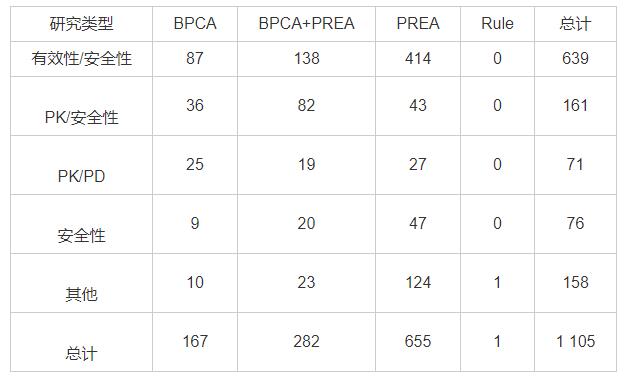
自1994年《儿科标签法》立法以来,美国的儿科用药信息得到不断完善,根据美国FDA官网数据显示[25],截至2019年11月30日,共有834项标签信息完成了修订补充,其中有764项进行了新的儿科临床研究,70项没有进行儿科临床研究。此外,FDA在2007年对《儿童最佳药品法案》(Best Pharmaceuticals for Children Act, BPCA)与《儿童研究公平法案》(Pediatric Research Equity Act, PREA)进行了重新授权并对儿科临床研究做出了详细规定,根据其对在BPCA法案和PREA法案指导下进行的儿科临床研究的相关统计数据显示[25],截至2019年12月31日,进行的儿科临床研究总数共1 105项,其中639项是针对药物在儿科人群中的安全性及有效性的研究,表1统计了研究类型及所依据的法规。
表1 美国儿科临床研究进展
3 我国儿科临床试验的管理现状
3.1 我国儿童用药及儿科临床试验的相关政策
相较于美国,我国儿科药物的政策立法起步较晚,但随着近年来儿童用药需求的不断上涨,我国对于儿童用药问题持续密切关注。2011年,鼓励儿童专用药品研发和生产已在《中国儿童发展纲要(2011—2020年)》中体现,首次把儿童用药短缺问题提到国家层面。2012年,《国家药品安全“十二五”规划》明确指出鼓励儿童适宜剂型研发。2014年的《关于保障儿童用药的若干意见》从鼓励研发创制、加快申报审评、确保生产供应、强化质量监管、推动合理用药、完善体系建设、提升综合能力等环节对保障儿童用药提出了具体要求。2016年多部委联合发布了《首批鼓励研发申报儿童药品清单》(以下简称《清单》),2017年发布了第2批《清单》,2019年发布了第3批《清单》。3批《清单》的发布突出了儿童适宜剂型、规格的申报,有利于引导企业合理组织生产。同样,为完善儿科临床/非临床试验制度,加强研发技术指导,我国已发布了5项针对儿科人群药物临床试验的指导原则,包括《儿科人群药代动力学研究技术指导原则》、《儿科人群药物临床试验技术指导原则》、《成人用药数据外推至儿科人群的技术指导原则》、《儿科用药临床药理学研究技术指导原则》以及《儿童用药(化学药品)药学开发指导原则(试行)》,有针对性地做好儿童用药研发的技术指导,规范儿童用药研究。2017年3月原国家食品药品监督管理总局药品审评中心(CDE)发布《儿科用药非临床安全性研究技术指导原则(征求意见稿)》,明确统一儿科用药的非临床安全性评价技术要求。2018年4月《药品试验数据保护实施办法(暂行)》公开征求意见,规定对申请人基于自行取得的试验数据获得上市许可的儿童专用药,给予一定数据保护期限。2018年底,人用药品注册技术规范国际协调会(ICH)指导原则《S11:支持儿科用药开发的非临床安全性评价》进入第3阶段征求意见,国内与国际ICH儿科用药非临床安全性评价技术接轨。2019年11月,国家药品监督管理局决定适用《E11(R1):用于儿科人群的医学产品的药物临床研究》等15个ICH指导原则。
3.2 我国儿童用药鼓励政策取得的成效
从实施效果来看,近年来我国儿童用药鼓励政策取得了一定成效。据统计,首批《清单》发布后至2020年10月20日,已有4个品种上市,26个品种被CDE受理(第3批《清单》中共有39个品种在CDE获得受理,其中26个品种是在该清单发布后获得受理[1])。此外,为加快儿童用药的审评审批,2016年1月,原国家食品药品监督管理总局颁布了《关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告》[26],同时CDE公布了第1批优先审评儿童药品名单,以此为节点儿童用药正式进入获得优先审评审批权的时代。截至2020年10月20日,共计112件儿童用药注册申请事项获优先审评审批。
3.3 国内儿科临床试验发展面临的机遇与挑战
目前,我国已经建立了儿科临床试验体系,开展儿科临床试验所需的元素包括临床试验机构、企业、相关服务公司等都已具备。加之近年来我国儿童用药需求的不断上涨以及国家鼓励儿童药物开发政策陆续推出,儿科临床试验迎来了前所未有的发展机遇。与此同时,虽然我国已初步建立儿科药物临床试验的管理框架,但整个临床试验监督管理体系有待进一步完善,临床试验的监管仍存在伦理委员会对儿童药物临床试验项目把关不严、试验过程缺乏对儿童受试者的风险评估、部分伦理委员会的独立性难以保证、风险管理的职责在GCP检查过程中涉及较少等问题[27-29],这些问题可以说既是我国药品监管体系的短板,同时也是未来我国儿科临床研究走向高质量发展所面临的挑战。
4 改善我国儿科临床试验管理的建议
儿童用药的研发既需要国家政策的及时推进,同时也离不开完善的监管体系保驾护航。针对我国目前儿童用药开发缓慢、临床试验监管不完善等问题,如何从源头上改善儿童用药的质量管理,提升儿童用药可及性,本文在分析美国促进儿科临床试验开展的政策举措及监管经验的基础上,结合我国国情,从优化儿童用药政策环境以及创新临床试验监管2个层面提出以下改善我国儿科临床试验管理的建议。
4.1 优化儿童用药政策环境
4.1.1 完善儿童用药专利保护期限补偿制度
目前,我国的临床试验数据保护仅针对儿童专用药新适应证的获批,数据保护权利范围与美国的6个月专利期延长相比对制药企业的吸引力有限。从美国儿童用药政策实施成效来看,儿科6个月独占条款的实施是比较成功的。因此,建议对增加新适应证、改变新剂型、改变给药途径的儿童用药给予一定期限专利保护。制药企业在获得市场独占的情况下,可以获得丰厚利润,正向激发企业的研发积极性。
4.1.2 将儿童用药研究纳入药物研发体系
儿童用药的研发仅有政策上的鼓励是不够的,还应制定强制的研发条款,强制企业加大儿童用药研发力度。建议单独制定儿童用药研发条款,要求研究者在新药研制的早期阶段递交儿童用药初期研究计划,使新药研发早期阶段必须考虑未来能否适用于儿童,并根据计划同步开展儿童用药临床试验。或者可以临床亟须治疗的儿童恶性疾病为试点,强制结合相应鼓励政策,引导企业在新药研发中同步或承诺在规定期限内开展儿童用药研究。
4.1.3 加大对儿童用药研究的资金扶持力度
我国儿童用药开发缓慢,主要原因之一在于儿科基础研究水平薄弱。因此,建议“重大新药创制”科技重大专项单列儿科创新药研发支持计划,支持方式从多、小、散向集中委托攻关转变,支持的重心从下游向上游转移,由应用技术研究逐渐转向基础研究和原始创新,突破一批核心关键技术,从传统药物向基因治疗、细胞治疗等新型药物和诊断产品等个性化用药拓展。针对专利过期药物,由国家划拨资金并提供技术指导,支持儿童用药研究,完善儿童用药信息。
4.2 创新临床试验监管
4.2.1 成立专业的儿童伦理委员会
我国现行的伦理委员会审查制度的不足之一是难以保证伦理审查的独立性。针对这个问题,本文建议在部分临床试验资源丰富的地区设立儿童的专业伦理委员会,核心成员包括专业儿科医务人员、儿科疾病专家、儿童心理学专家以及法律专家等,专业伦理委员会主要负责儿科临床试验的主审和机构伦理委员会的补审,这样既可以解决机构伦理委员会的独立性问题,也能进一步提升伦理审查的专业度和审查效率。
4.2.2 加快完善临床试验保险制度
完善的临床试验保险制度不仅能降低临床试验参与者的研究风险,也使受试者的权益得到了有力保障。建议监管机构以法律为约束,在风险较大的Ⅰ期临床试验建立强制保险制度,随后将制度逐渐推进到Ⅱ期~Ⅳ期临床试验中执行。在GCP中应强制规定有儿童参与的临床试验,试验申办者必须购买保险,以此提高各方参加临床试验的积极性,推动我国儿科临床试验的开展。
4.2.3 重视儿科专业人才培养及临床试验的宣传教育
我国儿科临床试验推进困难,主要原因之一在于儿科临床专业人才缺乏。建议政府加大对现有儿科专业人才的扶持,提高其福利待遇,高校可以进一步深化儿科方向的本科和研究生的培养、单独开设儿科临床医学专业并扩大专业的招生规模,来强化我国儿科专业人才体系的建设。此外,我国在药物临床试验的宣传教育上还较为欠缺,社会公众对于临床试验的了解非常有限,参与临床试验的积极性较低。建议我国临床试验机构可以借助媒体的力量,积极宣传普及临床试验知识,加深公众对于药物临床试验原理与意义的了解。
参考文献
[1] 中国医药工业信息中心.中国新药研发监测数据库(CPM)[EB/OL].[2020-10-12].http://cpm.pharmadl.com/.
[2] 中华人民共和国国家统计局.中国统计年鉴[M].北京:中国统计出版社,2020.
[3] FDA.Clinicaltrials.gov[EB/OL].[2020-11-04].https://clinicaltrials.gov/.
[4] U.S.GOVERNMENT ACCOUNTABILITY OFFICE.Pediatric Drug Research:Studies Conducted under Best Pharmaceuticals for Children Act[EB/OL].[2020-11-04].https://www.gao.gov/assets/gao-07-557.pdf.
[5] 中国医院协会病案管理专业委员会.第二十四届学术会议论文集汇编[C].中国医院协会病案管理专业委员会,2015.
[6] 赵崇涛,张立英.我国儿童肿瘤疾病的发展状况及预防的初探[J].中国民康医学,2015,27(12):81-83.
[7] 海莉丽,朱琳,李智平.药物制剂辅料在儿童群体中的安全性考量[J].中国药学杂志,2019,54(14):1121-1125.
[8] 王之羽,石雅丽,王敏,等.儿科门诊患者家庭用药管理现状分析[J].中国现代应用药学,2019,36(12):1565-1568.
[9] 李莉霞,王晓芸,李方,等.家长对儿童药物临床试验认知与态度调查[J].儿科药学杂志,2019,25(3):43-47.
[10] IC.Regulation of drugs for children in Europe[J].BMJ,2007,335(7632):1211-1222.
[11] 姜亚莉,徐亮,蔡萍,等.医院药物临床试验质量管理措施探讨[J].中国卫生产业,2018,15(6):67-68.
[12] FDA.Food And Drug Administration Modernization Act of 1997[EB/OL].[2020-11-04].https://www.cov.com/-/media/files/corporate/publications/1997/12/oid6193.pdf.
[13] 潘家梅,张象麟.美国激励研制罕见儿科疾病药品的“优先审评券计划”制度概述[J].中国药事,2019,33(1):50-55.
[14] FDA.TitleⅣ-Pediatric Research Equity Act of 2007[EB/OL].[2020-11-04].http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/DevelopmentResources/UCM049870.pdf.
[15] FDA.Food and Drug Administration Safety and Innovation Act[EB/OL].[2020-11-04].https://www.fda.gov/media/96077/download.
[16] FDA.TitleⅤ-Best Pharmaceuticals for Children Act of 2007[EB/OL].[2020-11-04].http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/DevelopmentResources/UCM 049870.pdf.
[17] FDA.S.830-Pediatric Medical Device Safety and Improvement Act of 2007[EB/OL].[2020-11-04].https://www.congress.gov/110/bills/s830/BILLS-110s830is.pdf.
[18] 万征,范玉明.国内外药物临床试验GCP检查概述与启示[J].中国药事,2018,32(4):423-431.
[19] 高敏洁.美国FDA对新药临床试验申办者和合同研究组织的监管模式[J].中国新药与临床杂志,2016,35(2):109-113.
[20] 刘昌孝.国际药品监管科学发展概况[J].药物评价研究,2017,40(8):1029-1043.
[21] 王迪.FDA设立监管科学中心[EB/OL].(2014-06-04).[2018-05-23].http://web.yyjjh.com:8080/html/2014/06/04/content_209729.htm.
[22] FDA.Centers of Excellence in Regulatory Science and Innovation (CERSI)[EB/OL].(2018-04-09)[2020-11-04].http://www.fda.gov/scienceresearch/specialtopics/regulatoryscienceucm 301667.htm.
[23] 王婧璨,温宝书,陈成立.美国新药临床试验期间沟通交流机制简介与思考[J].中国新药杂志,2020,29(11):1222-1226.
[24] 陈永法,黄丽.美国FDA对药物临床试验的监管[J].中国新药杂志,2012,21(14):1578-1582.
[25] FDA.New Pediatric Labeling Information Database,September 2019[EB/OL].[2020-11-04].https://www.accessdata.fda.gov/scripts/sda/sdNavigation.cfm?sd=labelingdatabase.
[26] 药品审评中心.关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告[EB/OL].(2016-01-29)[2020-11-04].http://www.cde.org.cn/news.do?method=largeInfo&id=313519.
[27] 高荣,李见明.我国药物临床试验机构的发展、定位和职责探讨[J].中国临床药理学杂志,2012,28(9):714-717.
[28] 刘峰,李雪芹,王桂凤.机构质控员加强对药物临床试验质量控制的探讨[J].今日药学,2014,24(1):68-70.
[29] 周文菁,关灵,曹烨,等.药物临床试验质量管理·广东共识(2020年版)[J].今日药学,2020,30(12):826-829.
热门排行


