抑郁症模型大鼠海马内小胶质细胞数量和炎症因子表达增加
作者:admin 来源:未知 日期:2021-03-11 17:23人气:
摘 要:
目的 探讨慢性不可预知性应激(chronic unpredictable stress,CUS)抑郁症模型大鼠海马小胶质细胞总数量、活化小胶质细胞和炎症因子的变化情况。方法 选取6~8周龄的雄性Sprague-Dawley (SD)大鼠,在适应性饲养、糖水偏好基线调整及筛选后采用分层随机法分为空白对照组(n=19)和CUS干预组(n=48),给予CUS干预组大鼠5周的CUS干预,运用糖水偏好实验来评估两组大鼠的抑郁样行为,筛选出成模大鼠16只,即CUS模型组。采用免疫组织化学与体视学相结合的方法对两组大鼠海马各亚区小胶质细胞的总数量进行精确定量研究,运用免疫荧光方法评估大鼠海马各亚区活化小胶质细胞的密度,并采用实时定量PCR技术检测海马炎症因子的水平。结果 与空白对照组相比,CUS模型组大鼠的体质量明显下降(P<0.01)、糖水偏好百分比显著降低(P<0.01);CUS模型组大鼠海马CA1、CA2/3和DG区小胶质细胞的总数量较空白对照组均显著增加(P<0.001,P=0.002,P=0.002);CUS模型组大鼠海马CA1、CA2/3和DG区活化小胶质细胞的密度和比例较空白对照组均显著增加(P=0.011,P=0.015,P<0.001;P=0.018,P=0.019,P<0.001);相对于空白对照组,CUS模型组大鼠海马炎症因子IL-1β和iNOS的mRNA表达量显著升高(P=0.012,P=0.020)。结论 抑郁症模型大鼠海马各亚区内小胶质细胞总数量、活化小胶质细胞的密度和比例增加,炎症因子表达升高,表明海马小胶质细胞的改变可能参与抑郁症的病理过程。
关键词:
抑郁症 海马 小胶质细胞 白细胞介素1β 诱导型一氧化氮合酶 体视学
Increased number of microglia and enhanced expression of inflammatory factors in the hippocampus of rat model of depression
XIAO Kai LUO Yanmin LIANG Xin TANG Jing WANG Jin XIAO Qian QI Yingqiang LI Yue ZHU Peilin YANG Hao XIE Yuhan TANG Yong WU Hong
Department of Histology and Embryology,Laboratory of Stem Cells and Tissue Engineering,College of Basic Medical Sciences,Chongqing Medical University; Department of Physiology,College of Basic Medical Sciences,Chongqing Medical University; Department of Pathophysiology,College of Basic Medical Sciences,Chongqing Medical University; Department of Radioactive Medicine,College of Basic Medical Sciences,Chongqing Medical University;
Abstract:
Objective To investigate the changes of the total microglial number, density of activated microglia and inflammatory cytokines in the hippocampus of rat model of depression induced by chronic unpredictable stress(CUS). Methods Male Sprague-Dawley(SD) rats(6~8 weeks old) were randomly divided into control group(n=19) and CUS intervention group(n=48) with stratified randomization after adaptive feeding, sucrose preference baseline adjustment and screening. The rats of CUS intervention group were subjected to CUS intervention for 5 weeks. The depressive-like symptoms of 2 groups of rats were assessed with the sucrose preference test, and 16 model rats were screened out according to the results of sucrose preference. Immunohistochemical assay and stereological method were used to quantify the total number of microglia in the hippocampus of 2 groups of rats. The density of activated microglia in the hippocampus were studied with immunofluorescence assay. The contents of inflammatory cytokines in the hippocampus were measured with quantitative real-time polymerase chain reaction(qRT-PCR). Results The body mass and percentage of sucrose preference were significantly lower in the CUS model group than in the control group(P<0.01). The numbers of the microglia in the hippocampal CA1, CA2/3 and DG regions were significantly increased in the CUS model group compared with the control group(P<0.001, P=0.002, P=0.002), so were the density and proportion of the activated microglia in the CA1, CA2/3 and DG regions(P=0.011, P=0.015, P<0.001; P=0.018, P=0.019, P<0.001). Compared with the control group, the mRNA levels of inflammatory cytokines IL-1β and iNOS in the hippocampus were obviously higher in the model group(P=0.012, P=0.020). Conclusion The number of the microglia, density and proportion of activated microglia as well as levels of inflammatory cytokines are increased in the hippocampus of depression rats, indicating that the changes of hippocampal microglia might be involved in the pathogenesis of depression.
Keyword:
depression; hippocampus; microglia; interleukin-1beta; inducible nitric oxide synthase; stereology;
抑郁症是一种常见的精神疾病,其临床症状以情绪低落、快感缺失和内疚感为主[1],具有高发病率、高复发率并伴有自杀倾向的特点,严重降低患者的生活质量并增加全球的疾病负担[2]。因此,深入探讨抑郁症的发病机制、寻找新的治疗靶点具有非常重要的意义。
炎症反应作为抑郁症发病的重要假说之一[3],受到越来越广泛的关注。海马是抑郁症病理改变的关键脑区之一[4],同时,有研究表明抑郁症患者部分炎症相关基因的上调与海马体积的减少密切相关[5]。小胶质细胞是中枢神经系统的固有免疫细胞[6],而海马中的小胶质细胞在抑郁症的炎症反应过程中起着非常重要的作用[7-8]。有研究运用免疫荧光技术发现在慢性应激诱导的抑郁模型小鼠中海马小胶质细胞的密度有所增加[9-10],而有类似的研究采用同样的方法对慢性不可预知性应激(chronic unpredictable stress,CUS)模型小鼠小胶质细胞进行研究却得出了相反的结论[11-12]。以上研究表明小胶质细胞与抑郁症的发生、发展有着密切的联系,而目前抑郁症海马内小胶质细胞的变化仍然存在争议。此外,既往研究多为半定量研究,本研究运用现代体视学方法[13]对大鼠海马内小胶质细胞进行三维定量研究,以期更加准确、系统地探索抑郁症CUS模型大鼠海马内小胶质细胞的改变。
小胶质细胞在不同的情况下具有静息态、活化态这两种不同的状态。在应激等病理条件下,小胶质细胞被激活并增殖、迁移到受损区域,整合外周和中枢的炎症信号,最终影响神经元和其他脑细胞[14]。一项神经影像学研究表明,抑郁症患者海马中易位蛋白(一种小胶质细胞激活的标志物)的密度显著升高[15]。同时,在慢性应激模型动物中也发现小胶质细胞的活化和炎症因子升高,这种改变与动物对慢性应激所致的抑郁样行为的易感性增加相关[16]。因此,海马内活化小胶质细胞和伴随的神经炎症失调可能在抑郁症的发展过程中起着至关重要的作用,但抑郁症大鼠海马各亚区活化小胶质细胞的具体变化情况仍有待研究。
本研究采用免疫组织化学技术结合体视学方法定量研究抑郁症CUS模型大鼠海马各亚区内小胶质细胞数量的变化,通过免疫荧光技术系统研究CUS模型大鼠海马各亚区内小胶质细胞的活化情况以及运用实时定量PCR方法观察其海马神经炎症的基因表达情况,以期进一步揭示抑郁症海马的病理改变,为抑郁症的机制研究提供重要的基础研究数据。
1 材料与方法
1.1 材料
1.1.1 实验动物
选取6~8周龄、体质量为180~220 g的雄性SD大鼠(购自重庆医科大学实验动物中心),5只/笼,于室温 (22±1) ℃、恒定湿度(55±10)%和昼夜交替的环境中适应性喂养2周,自由进食进水。动物实验均按照实验动物管理和保护的有关规定进行。
1.1.2 试剂与耗材
兔抗离子化钙结合衔接分子1(ionized calcium binding adapter molecule 1,Iba1)抗体(货号ab178847)、小鼠抗CD68抗体(货号ab955)购自英国Abcam公司;兔SP试剂盒(货号SP9001)、DAB 显色试剂盒(货号ZLI-9018)购自北京中杉金桥公司;DyLight549标记羊抗兔IgG荧光二抗(货号A23320)、DyLight488标记羊抗小鼠IgG荧光二抗(货号A23210)购自美国Abbkine公司。其他试剂:DAPI染色液(货号AR1176,武汉博士德公司);总RNA提取试剂盒(货号LS1040,北京普洛麦格公司);cDNA逆转录试剂盒(货号RR047A,日本TaKaRa公司);实时定量PCR试剂盒(货号B21202,美国Bimake公司)。
1.1.3 实验器材
包括:冰冻切片机(CM1950,德国Leica公司);体视学分析系统(丹麦Glostrup公司);体视学显微镜(BX51,日本Olympus公司);激光共聚焦显微镜(德国Zeiss公司);实时荧光定量PCR仪(CFX96,美国Bio-Rad公司)。
1.2 方法
1.2.1 实验动物分组及CUS模型的建立
在经历2周的糖水偏好基线调整后,根据糖水偏好测试结果筛选出糖水偏好基线平稳的大鼠67只, 采用分层随机法分为空白对照组(n=19) 和 CUS 干预组(n=48)。空白对照组大鼠 (4~5只/笼) 正常喂养,不给予任何应激。根据文献[17]的方法建立CUS模型,具体应激干预包括禁食/禁饮(≤20 h)、昼夜颠倒(24~48 h)、噪音(3~5 h)、夜间频闪(8~12 h)、空瓶刺激(2 h)、倾斜(≥20 h)、行为限制(≥2 h)、热水浴(42 ℃,5 min)、冰水浴(4 ℃,5 min)、潮湿垫料/空垫料(≥20 h)、电击(1 min)、摇床、夹尾(1 min)等。CUS干预组大鼠单笼喂养,每天给予2种应激,除昼夜颠倒外,每种应激在5 d内不重复,整个建模过程持续5周。在应激过程中每周固定时间对大鼠进行体质量测定和糖水偏好测试。在CUS应激结束后,根据糖水偏好测试结果筛选出成模大鼠16只,即为CUS模型组。
1.2.2 体质量测定
每周固定时间测量各组大鼠的体质量。
1.2.3 糖水偏好实验
该实验是评估抑郁症模型动物的核心症状——快感缺失的金标准[18]。在实验开始之前,每只大鼠需进行一段时间的糖水适应训练,直到大鼠的糖水偏好逐渐稳定。接着对大鼠进行糖水偏好测试,具体步骤简述如下:首先禁食禁水24 h,然后分别给予每只大鼠1瓶1%的糖水和1瓶白水,在12 h时交换两个瓶子的位置,24 h后分别称量剩余糖水和白水的瓶质量,并分别计算对应的消耗量。最后参照如下公式计算出大鼠的糖水偏好程度:糖水偏好百分比=糖水消耗量/(糖水消耗量+白水消耗量)×100%。
1.2.4 高架十字迷宫实验
用于评价大鼠在新异环境中的焦虑样行为[19]。装置由两条开臂和两条闭臂组成,每条臂长50 cm、宽10 cm、高40 cm。将大鼠放在装置的正中心区域,通过电脑系统记录在5 min内大鼠的开臂、闭臂进入次数以及在各个臂内的停留时间等参数。
1.2.5 标本取材和切片制备
在行为学测试结束后,每组随机选取5只大鼠。大鼠腹腔注射1%戊巴比妥钠(4 mL/kg)进行麻醉后,剖开胸腹腔并暴露出心脏,将灌注泵的针头刺入心尖并迅速剪开右心耳。先灌注含有肝素钠的生理盐水,当肝脏颜色变浅时继续灌注4%多聚甲醛直至四肢僵硬。灌注结束后剥离出完整的大脑,沿着纵轴将大脑切分为左右半脑,置于4%多聚甲醛液中固定。每只大鼠随机选取一侧半脑,用梯度蔗糖溶液(用0.1 mol/L的PBS稀释)脱水,包埋速冻后用冰冻切片机沿着大脑半球冠状面以50 μm的厚度连续切片。按照1/12的抽样分数对含有海马组织的部分进行等距随机抽样,每个大脑半球共得到12组切片样本。
1.2.6 免疫组织化学染色
从每组每只大鼠的切片样本中随机选取2组切片,即切片抽样分数为1/6。冰冻切片用0.01 mol/L的PBS漂洗10 min×3次,用0.3% Triton溶液(0.3 mL Triton×100+0.1 mL Tween20+100 mL 0.01 mol/L PBS)漂洗10 min×6次;3%内源性过氧化氢避光修复20 min,0.3%Triton溶液漂洗15 min×2次;枸橼酸盐溶液热水浴修复30 min,0.3%Triton溶液漂洗10 min×2 次;封闭液(10%山羊血清 SP9001、1%胎牛血清、0.1% 鱼明胶、0.3 mL Triton×100)37 ℃封闭2 h。然后加入抗Iba1抗体4 ℃ 孵育 48 h,0.3% Triton溶液漂洗10 min×6次;二抗(生物素标记羊抗兔IgG)37 ℃孵育3 h,0.3% Triton溶液漂洗10 min×6次;三抗(辣根酶标记链霉卵白素)37 ℃孵育2 h,0.3% Triton溶液漂洗10 min×6次。然后DAB避光显色1 min、去离子水和PBS各漂洗10 min,最后贴片固定、苏木精复染、梯度乙醇脱水、二甲苯透明、中性树脂封片。
1.2.7 体视学定量分析
在体视学系统中按照光学分合法[20]对Iba1+小胶质细胞进行计数,具体步骤如下:首先依据大鼠解剖图谱的规则在2.5倍物镜下划分海马3个亚区的边界(图1),然后在100倍油镜下统一设置参数:体视框的高度为15 μm,上表面保护高度为3 μm,面积抽样分数为6 %。然后根据光学体视框的禁线法则(图2),计数每个视野测试高度内胞体清晰聚焦的小胶质细胞数目,每隔2个视野测量切片的厚度(切片上表面与下表面之间的距离)。最后利用光学分合法计算海马各亚区内Iba1+小胶质细胞的总数目,公式如下:
N=∑Q-×1/ssf×1/asf×1/tsf
∑Q-为每只大鼠海马各亚区计数的Iba1+细胞的数量;ssf为切片抽样分数1/6;asf为面积抽样分数6%;tsf是高度抽样分数(测试框的高度/切片的平均厚度)。
图1 大鼠海马CA1、CA2/3和DG区的边界示意图
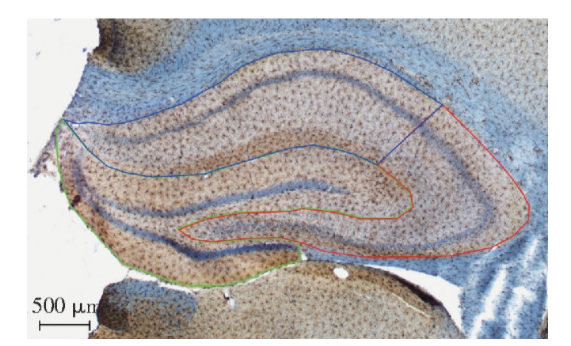

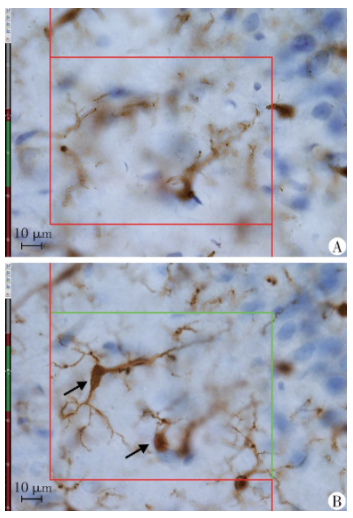
图2 体视框计数海马Iba1+小胶质细胞示意图

1.2.8 免疫荧光染色和细胞计数
从每组每只大鼠的切片样本中随机选取1组切片。切片用PBS漂洗10 min×3次, 0.3%Triton溶液(0.3 mL Triton×100+0.1 mL Tween20+100 mL 0.01 mol/L PBS)漂洗20 min×3次;枸橼酸盐溶液热水浴修复30 min,0.3%Triton溶液漂洗10 min×2 次;封闭液(10%山羊血清 SP-9001、1%胎牛血清、0.3 mL Triton ×100)37 ℃封闭2 h。随后加入抗Iba1抗体和抗CD68抗体,4 ℃,孵育60 h,0.3% Triton溶液漂洗20 min×3次;加入DyLight549标记羊抗兔IgG荧光二抗(红色)和DyLight488标记羊抗小鼠IgG荧光二抗(绿色),37 ℃孵育2 h,PBS漂洗5 min×6次;加入DAPI染细胞核,常温孵育5 min;贴片,封片。使用激光共聚焦显微镜的200 倍镜拍摄符合要求的荧光图像。每只大鼠切片海马的每个亚区至少获得10张具有代表性的图像。对每张图像的Iba1+/CD68+细胞进行手动计数并计算阳性细胞的密度。
1.2.9 实时定量PCR
从每组动物中随机选取5只大鼠进行实时定量PCR分析。将大鼠麻醉、断颈并取出完整大脑,迅速分离出海马组织,经液氮冷冻后于-80 ℃保存。按照说明书的步骤,用总RNA提取试剂盒从海马中提取总RNA,在测定RNA浓度后,用逆转录试剂盒进行逆转录得到cDNA。IL-1β上游引物:5′-TGAG-GCTGACAGACCCCAAAAGAT-3′,下游引物:5′-GCTCC-ACGGGCAAGACATAGGTAG-3′,产物长度181 bp;iNOS上游引物:5′-GAGACGCACAGGCAGAGGTTG-3′,下游引物:5′-AGCAGGCACACGCAATGATGG-3′,产物长度123 bp;IL-6上游引物:5′-ACTTCCAGCCAGTTGCCTT-CTTG-3′,下游引物:5′-TGGTCTGTTGTGGGTGGTAT-CCTC-3′,产物长度110 bp;TNF-α上游引物:5′-TCG-TAGCAAACCACCAAGCG-3′,下游引物:5′-AGAGAAC-GGATGAACACGCCA-3′,产物长度452 bp;β-actin上游引物:5′-TGTCACCAACTGGGACGATA-3′,下游引物:5′-GGGGTGTTGAAGGTCTCAAA-3′,产物长度165 bp。使用实时定量PCR试剂盒进行PCR扩增反应,并用实时荧光定量PCR仪检测PCR的产物。最后以β-actin为内参,用2-ΔΔCt法对基因的相对mRNA表达量进行统计分析。
1.3 统计学分析
使用SPSS 23.0统计软件对数据进行分析。数据先进行正态性检验后,若符合正态分布数据以x¯±s表示,否则以中位数(四分位数间距)表示。体质量数据采用重复测量的方差分析,高架十字迷宫实验部分数据采用Mann-Whitney U检验,其他数据的两组间比较则采用独立样本t检验。检验水准α=0.05。
2 结果
2.1 CUS模型大鼠的体质量降低
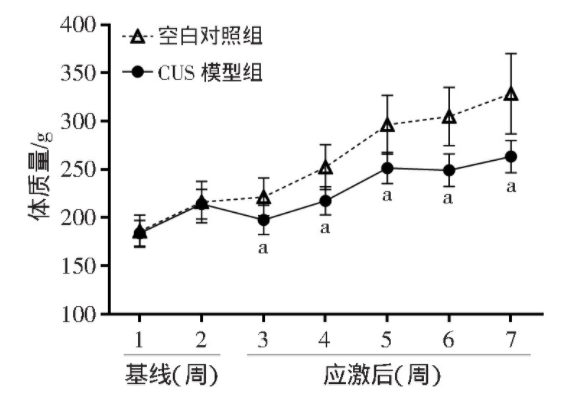
在基线调整阶段,CUS模型组大鼠与空白对照组大鼠的体质量差异无统计学意义。CUS干预开始后,空白对照组大鼠的体质量逐渐增加,CUS模型组大鼠体质量的增长速度较空白对照组显著变缓,且CUS模型组大鼠的体质量与空白对照组相比显著降低(P<0.01,图3)。
图3 两组大鼠CUS干预前后体质量变化
2.2 CUS模型大鼠的糖水偏好百分比降低
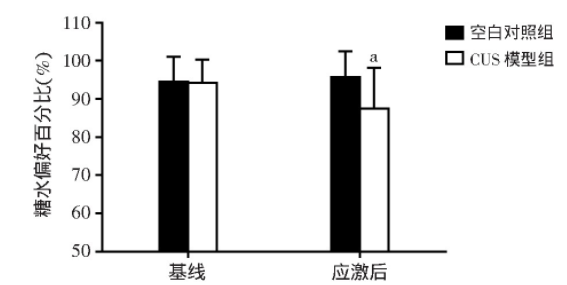
在应激干预前,CUS模型组和空白对照组大鼠糖水偏好百分比差异无统计学意义(t=1.058,P=0.298);在持续5周的应激干预后,CUS模型组大鼠的糖水偏好百分比较空白对照组大鼠显著降低(t=4.488,P<0.01,图4)。
2.3 CUS模型大鼠不伴有焦虑样行为
CUS模型组大鼠和空白对照组大鼠的进臂总次数、开臂进入次数和停留时间、闭臂进入次数和停留时间、开臂进入次数百分比以及开臂停留时间百分比等参数差异均无统计学意义(表1)。
图4 CUS干预前后两组大鼠糖水偏好百分比
2.4 CUS模型大鼠海马内小胶质细胞总数量增加
图5为各组大鼠海马各亚区Iba1+小胶质细胞组织化学染色的代表性图像,与空白对照组大鼠海马各亚区小胶质细胞的形态相比,CUS模型组的Iba1+小胶质细胞的分布更为密集。运用体视学方法计算分析后发现,CUS模型组大鼠海马CA1区Iba1+小胶质细胞数量较空白对照组显著增加(t=-8.141,P<0.001), CA2/3区Iba1+小胶质细胞数量较空白对照组显著增加(t=-4.376,P=0.002), DG区Iba1+小胶质细胞数量较空白对照组显著增加(t=-4.427,P=0.002,图6)。
表1 两组大鼠高架十字迷宫实验结果[x¯±s,中位数(四分位数间距)]
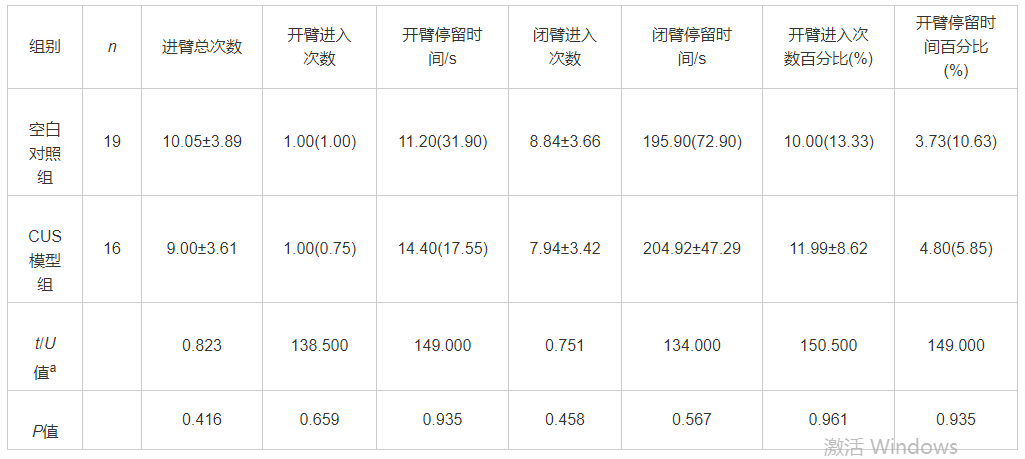
图5 两组大鼠海马各区Iba1+小胶质细胞的免疫组化染色观察 (S-P)
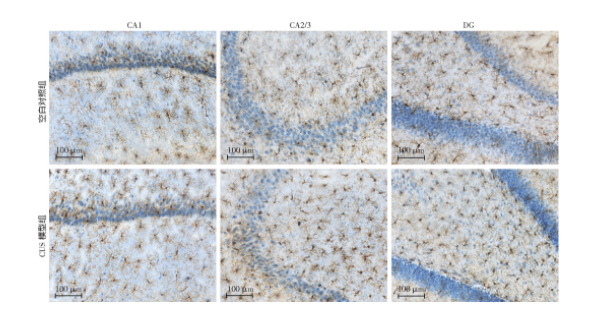
图6 两组大鼠海马各区Iba1+小胶质细胞总数量的比较
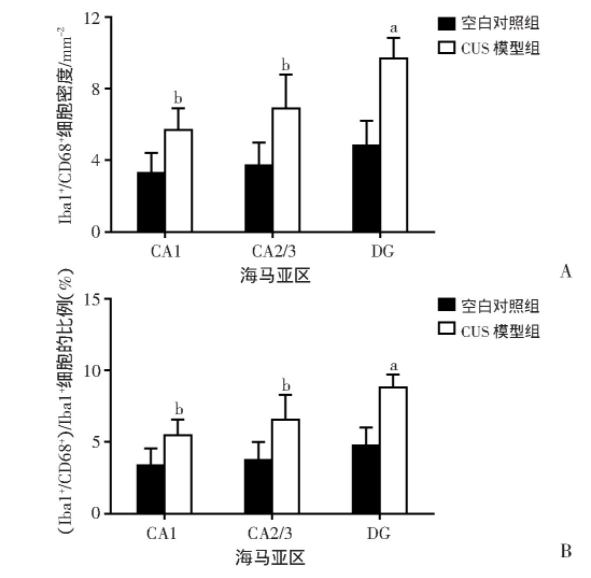
2.5 CUS模型大鼠海马内活化小胶质细胞密度和比例增加
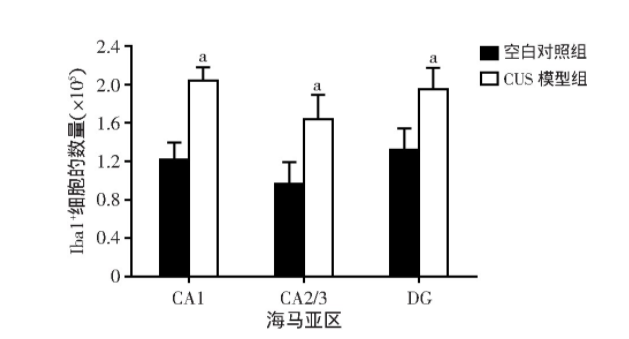
图7为大鼠海马Iba1+/CD68+小胶质细胞免疫荧光染色的代表性图像,与空白对照组相比,CUS模型组大鼠海马各区Iba1+/CD68+小胶质细胞分布较为密集。通过计数发现:与空白对照组相比,CUS模型组大鼠海马CA1区Iba1+/CD68+小胶质细胞的密度明显升高(t=-3.271,P=0.011);与空白对照组相比,CUS模型组大鼠海马CA2/3区Iba1+/CD68+小胶质细胞的密度明显升高(t=-3.099,P=0.015);与空白对照组相比,CUS模型组大鼠海马DG区Iba1+/CD68+小胶质细胞的密度显著升高(t=-6.094,P<0.001)。同时,与空白对照组相比,CUS模型组大鼠海马CA1区Iba1+/CD68+小胶质细胞占Iba1+小胶质细胞的比例明显升高(t=-2.958,P=0.018);与空白对照组相比,CUS模型组大鼠海马CA2/3区Iba1+/CD68+小胶质细胞占Iba1+小胶质细胞的比例明显升高(t=-2.913,P=0.019);与空白对照组相比,CUS模型组大鼠海马DG区Iba1+/CD68+小胶质细胞占Iba1+小胶质细胞的比例显著升高(t=-5.801,P<0.001,图8)。
图7 大鼠海马活化小胶质细胞的免疫荧光染色观察
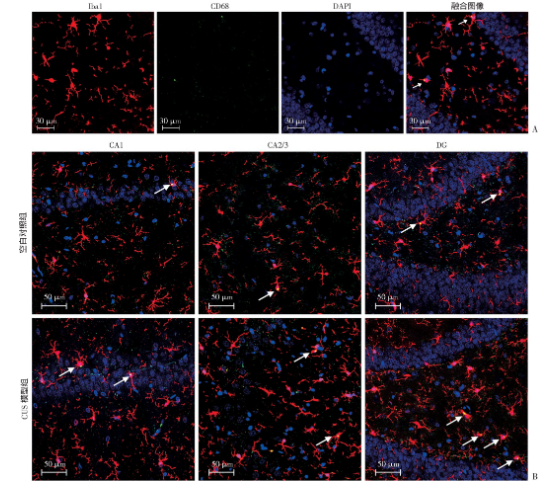
图8 两组大鼠海马各区活化小胶质细胞计数
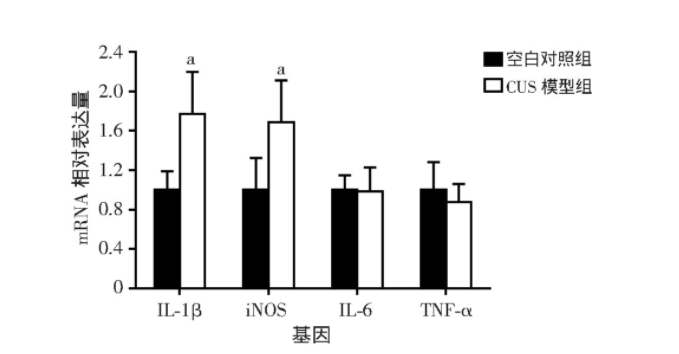
2.6 CUS模型大鼠海马炎症因子IL-1β和iNOS的mRNA表达水平升高
通过实时定量PCR检测发现,CUS模型组大鼠海马炎症因子IL-1β和iNOS的mRNA表达量较空白对照组显著升高(t=-3.667,P=0.012;t=-2.884,P=0.020),而CUS模型组和空白对照组大鼠海马炎症因子IL-6和TNF-α的mRNA表达量差异无统计学意义(图9)。
图9 实时定量PCR检测两组大鼠海马IL-1β、iNOS、IL-6和 TNF-α mRNA表达
3 讨论
抑郁症是一种常见的由生物、心理与环境等多方面因素导致的精神情绪障碍性疾病,而外界的慢性应激是抑郁症的重要致病因素之一[21]。本研究采用经典的CUS来诱导大鼠的抑郁样行为,并运用糖水偏好实验来评价抑郁症大鼠的核心症状——快感缺失。结果发现:CUS干预后的大鼠糖水偏好百分比显著降低,并伴有体质量的增长速度明显减慢。以上结果表明在为期5周的CUS干预后抑郁症大鼠模型建立成功。此外,本研究也采用高架十字迷宫实验来评估大鼠有无焦虑样行为,结果显示CUS模型组和空白对照组的各项高架十字迷宫参数差异均无统计学意义,表明本实验的抑郁症CUS模型大鼠不伴有焦虑。
海马对外界应激高度敏感[22],并且有研究指出海马可能是参与抑郁症神经炎症反应的重要脑区之一[5]。目前大多数关于抑郁症的研究都集中在海马神经元的功能障碍上,对胶质细胞如小胶质细胞的研究较少。小胶质细胞是类似于单核巨噬细胞的中枢免疫效应细胞[6],在应激等病理情况下小胶质细胞可以被激活并对神经元等有损害作用[14]。Iba1在所有小胶质细胞(包括静息态和活化态)中组成性表达[23],是目前小胶质细胞比较公认的标记物。对小胶质细胞Iba1标记物的分析[24]结合抑郁症状的评估可能有助于预测抑郁症的进程。在本实验中,我们采用精确的体视学定量方法发现CUS模型大鼠海马CA1、CA2/3和DG区Iba1+小胶质细胞的数量均显著增加。以前有研究运用免疫荧光技术也发现在慢性应激诱导的抑郁模型动物整个海马或DG区内小胶质细胞的密度有所增加[9-10],此外也有研究采用免疫荧光技术发现抑郁模型小鼠海马内小胶质细胞密度有所降低[11-12]。这些运用免疫荧光技术的研究仅使用半定量的方法对海马二维平面的小胶质细胞进行评估,无法对小胶质细胞总数量的变化进行客观真实的反映。本研究运用无偏体视学技术三维精确定量海马各亚区内小胶质细胞的变化,结果更加精确可靠和全面。本研究结果表明抑郁模型大鼠海马小胶质细胞总数目的增加可能是抑郁症的重要病理改变之一。
除了小胶质细胞的总数量变化外,小胶质细胞的活化在抑郁症的发生发展过程中也起着十分重要的作用[25]。CD68是活化小胶质细胞的理想标记物[26],其水平在抑郁症模型中有所上升[27]。FENG等[28]的研究表明慢性温和应激(chronic mild stress,CMS)增加了小鼠海马DG区活化/吞噬小胶质细胞的密度。然而关于CUS抑郁模型大鼠海马各亚区内活化小胶质细胞的具体变化仍有待研究。本研究通过抗Iba1抗体和抗CD68抗体的免疫荧光染色来标记活化状态的小胶质细胞并结合激光共聚焦显微镜观察,发现CUS显著增加了大鼠海马CA1、CA2/3和DG区Iba1+/CD68+细胞的密度及占Iba1+小胶质细胞的比例,表明慢性应激诱导了海马各亚区内小胶质细胞的活化。在病理条件下,小胶质细胞会逐渐偏离稳态并转变为激活状态[14]。同时,许多应激相关的因素(如应激激素升高、神经递质水平改变等)都可以诱发小胶质细胞的激活[29]。在本研究中,CUS干预包含的各种应激可能是活化小胶质细胞增加的主要因素之一。然而,与应激联系密切的小胶质细胞激活的具体机制有待进一步研究。
此外,本研究还发现CUS干预增加了大鼠海马炎症因子IL-1β和iNOS的基因表达水平,这些结果与先前的研究一致[30-31]。然而抑郁症模型大鼠海马IL-6和TNF-α的基因表达水平没有显著变化,推测这可能是因为抑郁症的炎症反应过程受到多方面因素的影响。同时,小胶质细胞分泌的IL-1β和iNOS有助于扩大抑郁症的炎症反应并引起相应的病理改变[32-33],这说明抑郁症的神经炎症过程中IL-1β、iNOS比IL-6和TNF-α的变化更灵敏。总之,本研究结果表明小胶质细胞的活化和炎症因子IL-1β、iNOS的升高可能促进抑郁症的发生、发展。
综上所述,本研究运用无偏体视学方法、免疫荧光技术和实时定量PCR技术对抑郁症模型大鼠海马的小胶质细胞和神经炎症因子进行了研究,结果显示抑郁模型大鼠海马各区小胶质细胞总数量增加、活化小胶质细胞密度和比例增加以及炎症因子升高,提示海马小胶质细胞可能是抑郁症病理改变的重要结构基础。未来深入研究抑郁症小胶质细胞改变的具体机制,将有机会为抑郁症提供新的治疗靶点和治疗措施。
参考文献
[1] BARNETT R.Depression[J].Lancet,2019,393(10186):2113.DOI:10.1016/S0140-6736(19)31151-1.
[2] OTTE C,GOLD S M,PENNINX B W,et al.Major depressive disorder[J].Nat Rev Dis Primers,2016,2:16065.DOI:10.1038/nrdp.2016.65.
[3] MILLER A H,RAISON C L.The role of inflammation in depression:from evolutionary imperative to modern treatment target[J].Nat Rev Immunol,2016,16(1):22-34.DOI:10.1038/nri.2015.5.
[4] TAYLOR W D,MCQUOID D R,PAYNE M E,et al.Hippocampus atrophy and the longitudinal course of late-life depression[J].Am J Geriatr Psychiatry,2014,22(12):1504-1512.DOI:10.1016/j.jagp.2013.11.004.
[5] MAHAJAN G J,VALLENDER E J,GARRETT M R,et al.Altered neuro-inflammatory gene expression in hippocampus in major depressive disorder[J].Prog Neuropsychopharmacol Biol Psychiatry,2018,82:177-186.DOI:10.1016/j.pnpbp.2017.11.017.
[6] WAKE H,MOORHOUSE A J,MIYAMOTO A,et al.Microglia:actively surveying and shaping neuronal circuit structure and function[J].Trends Neurosci,2013,36(4):209-217.DOI:10.1016/j.tins.2012.11.007.
[7] TORRES-PLATAS S G,CRUCEANU C,CHEN G G,et al.Evidence for increased microglial priming and macrophage recruitment in the dorsal anterior cingulate white matter of depressed suicides [J].Brain Behav Immun,2014,42:50-59.DOI:10.1016/j.bbi.2014.05.007.
[8] CALCIA M A,BONSALL D R,BLOOMFIELD P S,et al.Stress and neuroinflammation:a systematic review of the effects of stress on microglia and the implications for mental illness [J].Psychopharmacology (Berl),2016,233(9):1637-1650.DOI:10.1007/s00213-016-4218-9.
[9] DONG S Q,ZHANG Q P,ZHU J X,et al.Gypenosides reverses depressive behavior via inhibiting hippocampal neuroinflammation[J].Biomed Pharmacother,2018,106:1153-1160.DOI:10.1016/j.biopha.2018.07.040.
[10] ZHAO Q,WU X,YAN S,et al.The antidepressant-like effects of pioglitazone in a chronic mild stress mouse model are associated with PPARγ-mediated alteration of microglial activation phenotypes[J].J Neuroinflam,2016,13(1):259.DOI:10.1186/s12974-016-0728-y.
[11] CAI Z,YE T,XU X,et al.Antidepressive properties of microglial stimulation in a mouse model of depression induced by chronic unpredictable stress[J].Prog Neuropsychopharmacol Biol Psychiatry,2020,101:109931.DOI:10.1016/j.pnpbp.2020.109931.
[12] TONG L,GONG Y,WANG P,et al.Microglia loss contributes to the development of major depression induced by different types of chronic stresses[J].Neurochem Res,2017,42(10):2698-2711.DOI:10.1007/s11064-017-2270-4.
[13] WEST M J,GUNDERSEN H J.Unbiased stereological estimation of the number of neurons in the human Hippocampus[J].J Comp Neurol,1990,296(1):1-22.DOI:10.1002/cne.902960102.
[14] YIRMIYA R,RIMMERMAN N,RESHEF R.Depression as a microglial disease[J].Trends Neurosci,2015,38(10):637-658.DOI:10.1016/j.tins.2015.08.001.
[15] SETIAWAN E,WILSON A A,MIZRAHI R,et al.Role of translocator protein density,a marker of neuroinflammation,in the brain during major depressive episodes [J].JAMA Psychiatry,2015,72(3):268-275.DOI:10.1001/jamapsychiatry.2014.2427.
[16] DAI J,DING Z,ZHANG J,et al.Minocycline relieves depressive-like behaviors in rats with bone cancer pain by inhibiting microglia activation in Hippocampus[J].Anesth Analg,2019,129(6):1733-1741.DOI:10.1213/ane.0000000000004063.
[17] WILLNER P,TOWELL A,SAMPSON D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93(3):358-364.DOI:10.1007/BF00187257.
[18] WILLNER P,MUSCAT R,PAPP M.Chronic mild stress-induced anhedonia:a realistic animal model of depression[J].Neurosci Biobehav Rev,1992,16(4):525-534.DOI:10.1016/s0149-7634(05)80194-0.
[19] WALF A A,FRYE C A.The use of the elevated plus maze as an assay of anxiety-related behavior in rodents[J].Nat Protoc,2007,2(2):322-328.DOI:10.1038/nprot.2007.44.
[20] TANG Y,JANSSEN W G M,HAO J D,et al.Estrogen replacement increases spinophilin-immunoreactive spine number in the prefrontal cortex of female rhesus monkeys[J].Cereb Cortex,2004,14(2):215-223.DOI:10.1093/cercor/bhg121.
[21] HAMMEN C.Stress and depression[J].Ann Rev Clin Psych,2005,1:293-319.DOI:10.1146/annurev.clinpsy.1.102803.143938.
[22] THOMAS R M,HOTSENPILLER G,PETERSON D A.Acute psychosocial stress reduces cell survival in adult hippocampal neurogenesis without altering proliferation [J].J Neurosci,2007,27(11):2734-2743.DOI:10.1523/JNEUROSCI.3849-06.2007.
[23] ITO D,TANAKA K,SUZUKI S,et al.Enhanced expression of Iba1,ionized calcium-binding adapter molecule 1,after transient focal cerebral ischemia in rat brain[J].Stroke,2001,32(5):1208-1215.DOI:10.1161/01.str.32.5.1208.
[24] SINGHAL G,BAUNE B T.Microglia:an interface between the loss of neuroplasticity and depression[J].Front Cell Neurosci,2017,11:270.DOI:10.3389/fncel.2017.00270.
[25] WACHHOLZ S,ESSLINGER M,PLUMPER J,et al.Microglia activation is associated with IFN-alpha induced depressive-like behavior[J].Brain Behav Immun,2016,55:105-113.DOI:10.1016/j.bbi.2015.09.016.
[26] MURPHY J E,TEDBURY P R,HOMER-VANNIASINKAM S,et al.Biochemistry and cell biology of mammalian scavenger receptors[J].Atherosclerosis,2005,182(1):1-15.DOI:10.1016/j.atherosclerosis.2005.03.036.
[27] XU N,TANG X H,PAN W,et al.Spared nerve injury increases the expression of microglia M1 markers in the prefrontal cortex of rats and provokes depression-like behaviors[J].Front Neurosci,2017,11:209.DOI:10.3389/fnins.2017.00209.
[28] FENG X,FAN Y,CHUNG C Y.Mefenamic acid can attenuate depressive symptoms by suppressing microglia activation induced upon chronic stress[J].Brain Res,2020,1740:146846.DOI:10.1016/j.brainres.2020.146846.
[29] WOHLEB E S,FRANKLIN T,IWATA M,et al.Integrating neuroimmune systems in the neurobiology of depression[J].Nat Rev Neurosci,2016,17(8):497-511.DOI:10.1038/nrn.2016.69.
[30] LIU L L,LI J M,SU W J,et al.Sex differences in depressive-like behaviour may relate to imbalance of microglia activation in the hippocampus[J].Brain Behav Immun,2019,81:188-197.DOI:10.1016/j.bbi.2019.06.012.
[31] 王玥,万腾飞,段春梅,等.Sirt1通过促进海马中小胶质细胞向M2型转化改善慢性温和不可预知性应激模型小鼠的抑郁样行为[J].第三军医大学学报,2019,41(14):1301-1307.DOI:10.16016/j.1000-5404.201901077.WANG Y,WAN T F,DUAN C M,et al.Sirt1 ameliorates CUMS-induced depression-like behaviors in the mice via promoting hippocampal microglia M2-polarization[J].J Third Mil Med Univ,2019,41(14):1301-1307.DOI:10.16016/j.1000-5404.201901077.
[32] BROWN G C,NEHER J J.Microglial phagocytosis of live neurons[J].Nat Rev Neurosci,2014,15(4):209-216.DOI:10.1038/nrn3710.
[33] HE M C,SHI Z,SHA N N,et al.Paricalcitol alleviates lipopolysaccharide-induced depressive-like behavior by suppressing hypothalamic microglia activation and neuroinflammation[J].Biochem Pharmacol,2019,163:1-8.DOI:10.1016/j.bcp.2019.01.021.


