基于肠道菌群探讨维生素A缺乏对小鼠肠道屏障及炎症水平的影响
作者:admin 来源:未知 日期:2021-04-08 09:37人气:
摘 要:
目的 肠道菌群失衡与炎症性肠病的炎症反应联系紧密,但维生素A是否通过影响肠道菌群参与肠道屏障和肠道炎症的病理生理过程仍不完全清楚。探究肠道菌群介导的维生素A缺乏(VAD)对小鼠肠道屏障及肠道炎症的影响。方法 C57BL/6孕鼠抽签法分成维生素A正常饮食和VAD饮食。将雄性子鼠分为维生素A补充组(VAN组)、VAD组和维生素A缺乏补充组(VADN组),6只/组。VAN组和VAD组:分别自孕鼠VAN、VAD饮食,生后VAN、VAD孕鼠哺乳,断乳后予VAN、VAD饲料至11周龄;VADN组:11周龄VAD组子鼠改予VAN饮食继续喂养8周。评估各组小鼠体重;高效液相色谱法检测各组小鼠血清视黄醇水平;16s基因测序检测各组小鼠肠道菌群;HE染色、q-PCR和Elisa评价各组小鼠肠组织形态和隐窝深度,肠道屏障蛋白(Occludin和ZO-1)mRNA表达水平以及炎症因子(TNF-α和IL-6)蛋白表达水平。结果 与VAN相比,VAD组小鼠血清视黄醇水平较VAN组和VADN组显著降低(P<0.01)。与VAN组相比,VAD组小鼠OTUs数量降低。VAD组较VAN组小鼠Chao、Shannon指数数值降低,Simpson指数数值升高(P<0.05)。β多样性-主成分分析(PCoA)坐标显示,组间差异分布离散,其中VAD小鼠细菌群落结构占总变化的46.09%。OUT分布的维恩(Venn)图提示组间菌群分布存在差异。与VAN组比较,VAD组小鼠厚壁菌门与拟杆菌门(F/B)丰度比值上升(P<0.05)。VAN组和VADN组Occludin mRNA表达水平(1.00±0.07、0.96±0.04)较VAD组(0.44±0.02)显著升高(P<0.01);ZO-1 mRNA表达水平(1.00±0.03、1.06±0.03)亦较VAD组(0.64±0.02)显著升高(P<0.01)。而VAN组和VADN组炎症因子TNF-α[(58.75±25.74、74.55±22.47)pg/mg]较VAD组[(210.77±56.13)pg/mg]明显降低(P<0.01),IL-6含量[(28.25±10.74、50.66±12.47)pg/mg]较VAD组[(115.74±21.20)pg/mg]明显降低(P<0.01)。结论 VAD会导致小鼠肠道菌群失调,肠上皮黏膜通透性增强,促炎因子分泌增加,加重屏障功能损伤,是VAD导致肠道损伤的机制之一。
关键词:
维生素A 肠道菌群 肠道屏障 肠道炎症
Effect of vitamin A deficiency on intestinal barrier and inflammation in mice based on intestinal flora
ZHOU Jun-ming LI Min-li SUN Bo WU Xiao-wei WANG Bin GUO Mei-xia WANG Xiao-min
Department of Cadre Gastroenterology, General Hospital of Eastern Theater Command,PLA; The Fifth Station Outpatient Department, General Hospital of Eastern Theater Command,PLA;
Abstract:
Objective Imbalance of intestinal flora is closely associated with inflammatory response in inflammatory bowel disease, but it is still not fully understood whether vitamin A(VA) participates in intestinal barrier and pathophysiological process of intestinal inflammation through influencing intestinal flora or not. To explore the effect of VA deficiency mediated by intestinal flora on intestinal barrier and intestinal inflammation in mice. Methods C57 BL/6 pregnant mice were divided into VA-normal(VAN) or VA-deficient(VAD) diets by lottery. Immature offspring male mice were divided into VAN group, VAD group and VA deficiency supplement(VADN) group, 6 in each group. In VAN and VAD groups, the pregnant mice were fed with VAN and VAD diet. The baby mice were breast-fed until weaning and then fed with VAN/VAD diet to11-week old. In VADN group: the immature offspring mice in 11-week old were fed on VAN diet for 8 weeks. Weight of mice in each group was assessed. The levels of retinol were detected by high performance liquid chromatography(HPLC). 16 S gene sequencing was performed to detect intestinal flora of mice in each group. Intestinal tissue morphology and crypt depth, intestinal barrier protein(Occludin and Zo-1) mRNA expression levels, and inflammatory factors(TNF-α and IL-6) protein expression levels were assessed by HE staining, Q-PCR and Elisa. Results The level of serum retinol in VAD group was significantly lower than that in VAN group and VADN group(P<0.01). Compared with the VAN group, the number of OTUs in the VAD group was reduced. The values of Chao and Shannon indexes in VAD group were lower than those in VAN group, while those of Simpson index were higher(P<0.05). The β-diversity principal component analysis(PCoA) coordinates showed that the distribution of differences between groups was discrete, and the bacterial community structure of VAD mice accounted for 46.09% in the total changes. The Venn diagram of OUT distribution indicated that there were differences in the microflora distribution between groups. Compared with VAN group, the abundance ratio of Firmicutes and Bacteroidetes(F/B) increased in VAD group(P<0.05). The mRNA expression level of Occlud in VAN group and VADN group(1.00±0.07, 0.96±0.04) was significantly higher than that in VAD group(0.44±0.02)(P<0.01). The mRNA expression level of ZO-1 in VAN and VADN group(1.00±0.03, 1.06±0.03) was also significantly higher than that in the VAD group(0.64±0.02)(P<0.01). The inflammatory cytokines TNF-α concentration [(58.75±25.74, 74.55±22.47)pg/mg] in the VAN and VADN groups were significantly lower than that in the VAD group [(210.77±56.13)pg/mg](P<0.01), and the IL-6 concentration [(28.25±10.74, 50.66±12.47)pg/mg] was significantly lower than that in the VAD group [(115.74±21.20)pg/mg](P<0.01). ConclusionWe found VAD cause changes in intestinal microbiota, which promote in testinal epithelial permeability and intestinal inflammatory phenotype. These influences could be considered as an additional mechanism for effects of VAD onintestinal damage.
Keyword:
vitamin A; intestinal microbiota; intestinal barrier; intestinal inflammatory;
0 引 言
维生素A缺乏(vitamin A deficiency,VAD)已成为目前发展中国家面临的严重公共卫生问题之一[1]。维生素A的经典共识是维持正常视觉功能,维护上皮组织细胞的健康,促进免疫球蛋白的合成并维持骨骼肌正常生长发育[2]。新近临床及基础研究发现,体内维生素A水平参与多种肠道屏障功能相关疾病的病理过程[3]。肠道菌群是近年来被广泛研究的新生命体,被称为“隐藏的器官”,它包括的细菌体及其代谢产物参与多种营养、代谢、免疫生理过程[4-6]。肠道菌群失衡与炎症性肠病的炎症反应联系紧密,但维生素A是否通过影响肠道菌群参与肠道屏障和肠道炎症的病理生理过程仍不完全清楚[7]。
本研究以VAD模型小鼠为研究对象,通过16s DNA测序等方法分析其肠道菌群变化,肠黏膜渗透性和肠道局部炎症水平,探究维生素A在肠道菌群紊乱相关的肠道炎症损伤中的角色,为后续通过维生素A补充(VA-Normal,VAN)调节基于肠道菌群的肠道损伤提供新思路。
1 材料与方法
1.1 实验材料动物
实验所需8周龄C57BL/6雌性小鼠,32只,购自扬州大学比较医学中心,实验动物合格证号:SCXK(苏)2012-0004,小鼠饲养于SPF级标准动物房,室温25 ℃,自由进食进水,昼夜周期为12 h。小鼠定制纯化饲料VAD(VA <120 IU/kg)及VAN(VA 15000 IU/kg)购自常州鼠一鼠二动物饲料公司(各组小鼠饮食热量及其余成分摄入均匹配)。饲养过程及实验操作严格遵循美国国立卫生研究院实验动物护理及使用指南(NIH Publication No. 8023, revised 1978)。
实验仪器:StepOnePlusTM Real-Time PCR System(ABI,美国),酶标仪Model 560(Bio-Rad,美国),包埋机(俊杰电子,中国),冰冻切片机(Leica,德国),HPLC检测系统(Waters Millenium,美国),相差显微镜(Zeiss,德国)。
实验试剂:逆转录试剂盒(Abcam,美国),SYBR Premix Ex TaqTMII(TaKaRa,日本),HE染色套装(谷歌生物,中国),QIAamp©DNA Stool Mini Kit(Qiagen,德国),High-Sensitivity DNA Assay Kit(Life,美国),IlluiminaMiSeq System(Illumina,美国),目的基因和内参照引物(金斯瑞,中国),小鼠IL-6/TNF-α ELISA试剂盒(酶联生物,中国)。
1.2 方法
1.2.1 实验动物及模型建立
模型建立参照文献[8-9],将雄性子鼠分为VAN组、VAD组和维生素A缺乏补充(VAD-Normal, VADN)组,6只/组。VAN组:自孕鼠VAN饮食,子鼠生后VAN孕鼠哺乳,生后3周断乳,断乳后予VAN饲料至11周龄;VAD组:自孕鼠VAD饮食,生后VAD孕鼠哺乳,断乳后予VAD饲料至11周龄。VADN组:11周龄VAD组子鼠改予VAN饮食继续喂养8周。
1.2.2 血清维生素A水平检测
实验结束后10%水合氯醛腹腔注射麻醉小鼠,将预先准备好的合适长度毛细玻璃管从眼内眦呈45°角向小鼠眼内旋转刺入,避光收集血液,以离心半径13.5 cm、2000 r/min离心20 min 后取上清,收集好的样品送至上海艾迪康生物有限公司进行检测。
1.2.3 肠道菌群取样及测序分析
实验结束后小鼠消毒后在无菌环境中迅速取出盲肠,用灭菌止血钳将内容物挤压至专门收样管内,迅速液氮冷冻。按照建库试剂盒提取DNA后至长沙人与未来生物科技有限公司行16S rRNA基因测序。使用Qubit定量系统确定文库。
1.2.4 肠道组织切片HE染色
收集小鼠结肠组织,4%多聚甲醛固定后脱水、浸蜡、包埋、切片。依次苏木精染色-盐酸分化-伊红染色,接着梯度脱水脱蜡后用中性树胶封固,在显微镜下拍照观察并评价小鼠肠道组织结构及隐窝深度。
1.2.5 肠道屏障标志物q-PCR检测
收集小鼠肠组织冰上研磨,用Trizol法提取总RNA,按照逆转录试剂盒说明(42 ℃ 2 min,50 ℃ 15 min,85 ℃ 5 s)合成cDNA。q-PCR法进行目的基因扩增,扩增程序为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环次数40次。相对表达量用为2-△△CT计算方法。小鼠β-actin作为内参,引物设计来自Gene bank(PubMed),序列如下:ZO-1:Forward CAAAGCCCACCAAGGTCAC Reverse TCTCTTTCCGAGGCATTAGCA; Occludin: ForwardTGGCTATGGAGGCGGCTATGG Reverse ACCGATACCTCCGCCGATACC; β-actin: Forward GAGAGGGAAATCGTGCGTGACA Reverse ACCCAAGAAGGAAGGCTGGAAA。
1.2.6 肠道组织炎症因子ELISA检测
剪取各组小鼠肠道组织适量,洗涤后加入裂解液冰上裂解10 min,然后用超声研磨成细胞匀浆液,4 ℃下以离心半径8 cm、13 000 r/min离心10 min 后收集上清。按照ELISA说明书操作通过酶联免疫法测小肠组织TNF-α和IL-6的水平。样品浓度经过蛋白总量校正。
1.3 统计学分析
数据用GraphPad Prism 5.0分析作图,计量资料以均数±标准差(x¯±s)表示,数据符合正态分布且方差齐时采用单因素方差分析,不符合正态分布或转化无效时采用秩和检验。以P≤0.05为差异有统计学意义。肠道菌群生物信息学部分使用IlluminaMiSeq系统进行菌群数据分析,其中可操作分类单元(Operational Taxonomic Units, OTUs)、肠道菌群多样性评价指数(Chao,Shannon和Simpson指数)、β多样性-主成分分析(PCoA)、OUT分布的维恩(Venn)图、各个水平优势菌群分布、LEfSe鉴定分类学分支进化(Cladogram)图、分类单元的梯形图(LadderLogic Programming Language,LAD)均由IlluminaMiSeq系统软件计算。
2 结 果
2.1 VAD饮食对小鼠血清视黄醇水平和体重的影响
与VAN相比,VAD组小鼠血清视黄醇水平显著降低(P<0.01);与VAD组相比,VADN组小鼠视黄醇水平显著升高(P<0.01)。VAD组小鼠体重较VAN组有少许下降,但差异无统计学意义(P>0.05)。见表1。
表 1 各组小鼠体重及血清视黄醇水平(x¯±s)

2.2 VAD饮食对小鼠菌群结构的影响
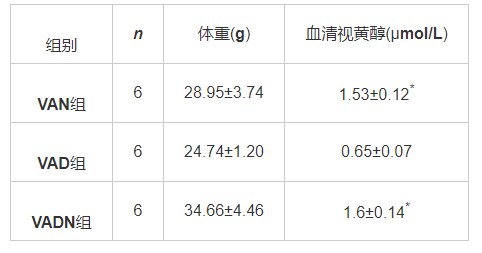
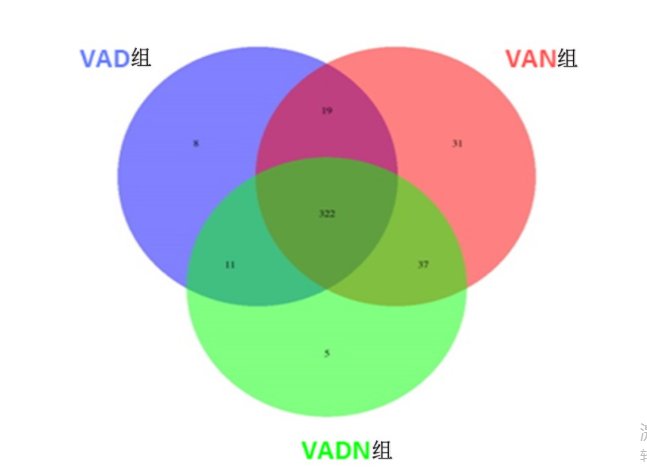
共从样本中获得669 359个有效序列,序列平均长度337 bp。将相似度大于97%的OTUs聚类比较,VAD组小鼠OTUs数量较VAN组降低,见图1。VAD组较VAN组小鼠Chao、Shannon指数数值降低,Simpson指数数值升高(P<0.05),见图2。β多样性-主成分分析(PCoA)坐标显示,3组小鼠肠道菌群组内构成重复性较好,但组间差异分布离散,其中VAD小鼠细菌群落结构占总变化的46.09%,见图3。OUT分布的维恩(Venn)图示8个OUTs为VAD小鼠独有,31个OUTs分布在VAN小鼠,提示组间菌群分布存在差异,见图4。
图 1 各组小鼠OTUs分布特征
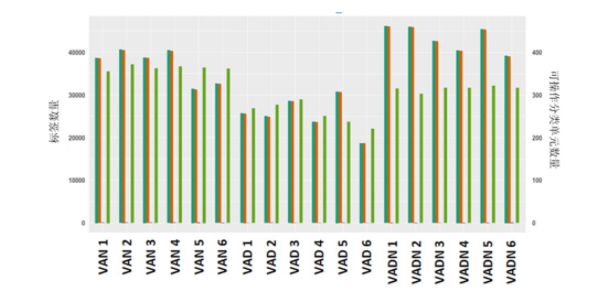

图 2 各组小鼠肠道菌群的Chao、Shannon及Shimpon指数
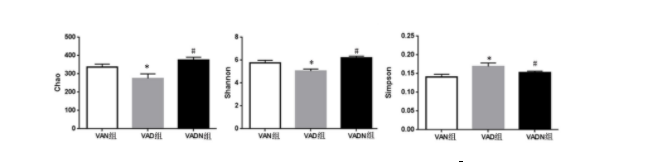

图 3 各组小鼠肠道菌群的主成分分析图(PCoA/PCA)图

图 4 各组小鼠肠道菌群的OTUs分布维恩图

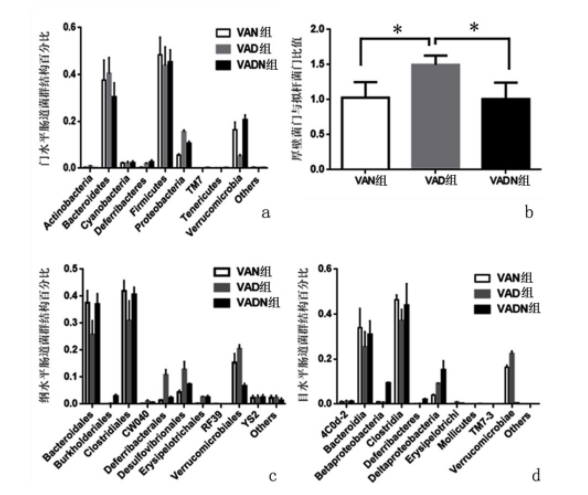
2.3 VAD饮食对小鼠各个水平优势菌群分布的影响
优势菌群分析显示门水平VAN小鼠的肠道菌群主要依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria)、脱铁杆菌门(Deferribacteres)、TM7、软壁菌门(Tenericutes)。相较于VAN组,VAD组小鼠的蓝藻菌门和疣微菌门相对丰度显著上升,脱铁杆菌门相对丰度明显下降;拟杆菌门和厚壁菌门丰度呈不同程度降低,变形菌门丰度升高。与VAN组比较,VAD组小鼠厚壁菌门与拟杆菌门(F/B)丰度比值上升(P<0.05),与VAD组比较,VADN组F/B丰度比值降低(P<0.05)。随着菌群不同水平分类细化,各组小鼠肠道菌群结构差异各有不同但有相似性,在纲水平和目水平,VAD小鼠的疣微菌系列丰度均显著升高。见图5。
图 5 不同水平上各组小鼠肠道菌群结构比例改变

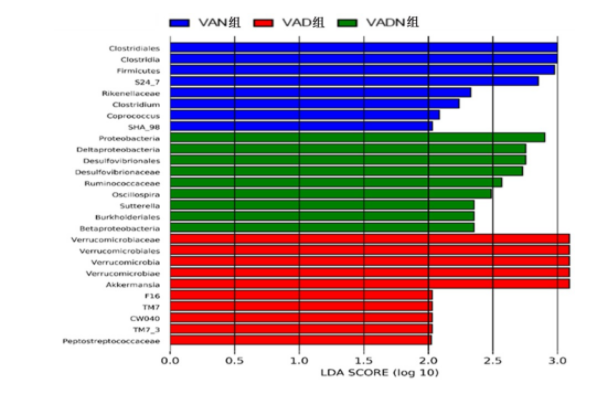
2.4 VAD饮食对小鼠肠道菌群核心差异分类单元的影响
宏基因组分析结果示,疣微菌门可作为VAN小鼠的生物标志物;TM7可作为VAN小鼠的生物标志物;变形菌门可作为VADN鼠的生物标志物,见图6。各组小鼠核心差异分类单元分析结果显示,VAD小鼠疣微菌门丰度增加最显著,见图7。
图 6 小鼠分类学分支进化(Cladogram)图
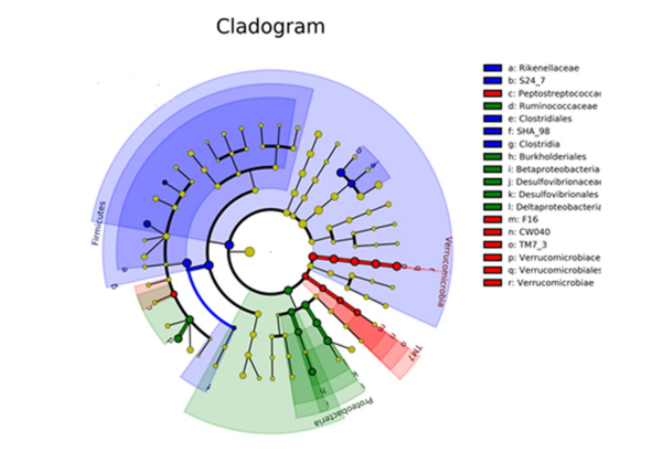

图 7 各组小鼠中富集的分类单元的梯形图

2.5 VAD饮食对小鼠肠道形态及肠道炎症水平的影响
染色结果表明,相比于VAN和VADN组小鼠,VAD小鼠肠黏膜形态上皮细胞排列紊乱,见图8。与VAD组比较,VAN组和VADN组Occludin和 ZO-1的mRNA表达水平显著升高(P<0.01),而炎性因子TNF-α和IL-6含量明显降低(P<0.01)。见表2。
图 8 镜下观察各组小鼠肠形态(HE ×20)
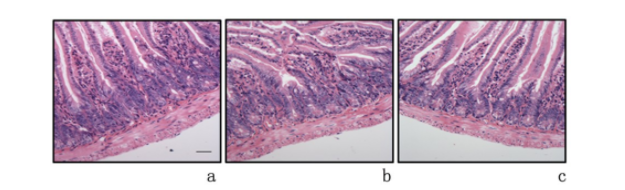

表 2 各组小鼠肠道紧密连接蛋白mRNA和相对道炎症因子蛋白表达水平(x¯±s)
3 讨 论
目前VAD诊断标准为血清视黄醇水平低于0.7 μmol/L[10]。研究证实,血清维生素A水平在肝维生素A稳态严格管控下,血清维生素A含量下降一般在肝储存的维生素A已无法满足机体维生素A代谢需求后出现[11-12]。产后3周被剥夺维生素A的小鼠20周龄时血清视黄醇水平仍正常[13]。本研究自妊娠开始利用VAD饮食诱导VAD模型小鼠,至11周龄时子鼠平均血清视黄醇浓度为0.65 μmol/L(<0.7 μmol/L),表明VAD模型小鼠构建成功,与既往文献结果基本一致[8-9]。此模型是我们下一步探究维生素A对肠道菌群改变及其对肠道屏障及炎症影响的基础。
肠道菌群的多样性、丰富度和均匀性是其发挥生物学功能的基础[14]。本研究中VAD小鼠肠道菌群丰度和多样性均下降,提示肠道菌群结构组成改变可能与体内维生素A水平相关。比较各组小鼠在不同分类水平上的菌群分布变化,VAD小鼠F/B比值显著升高,这与既往研究证实在鼠和人的肠道菌群中,F/B是主要优势菌群,其相对丰度比值是机体微生物结构的重要指标[15],F/B的比例失衡参与多种疾病状态的结论相似[16-17]。变形菌门在正常肠道内含量较低,常低于8%,且多数为致病菌,它异常扩增也是肠道微生物失调的微生物信号之一[18]。本研究中VAD小鼠变形菌门丰度显著升高,说明变形菌门改变可能是机体营养缺乏状态导致的病理表型之一。因此,维生素A或可通过影响厚壁菌、拟杆菌及变形菌此类具有针对有益菌及致病菌丰度调节作用的菌群丰度等来影响小鼠肠道微生物组成结构,但仍需要通过更有效的宏基因组表征肠道菌群功能水平上的代谢组分析,探索更详细的分级变化来阐明这些变化对肠道菌群及肠道功能的影响。
肠道菌群变化可通过多种途径参与机体免疫状态的调节[7]。肠黏膜上皮细胞的紧密连接蛋白-跨膜蛋白(Occludin等)和胞质蛋白(ZO-1等)的表达参与构建肠黏膜屏障,防止致病物质侵害[19-20]。我们进一步检测小鼠肠道屏障蛋白及肠道炎症因子的表达水平发现,VAD小鼠肠黏膜上皮细胞的Occludin和ZO-1mRNA表达明显下降,提示肠道上皮细胞紧密连接结构遭到破坏,肠黏膜通透性增加。既往研究发现VAD可诱导鸡和大鼠小肠形态和功能的改变,与我们的结果部分一致[21-22]。有研究证实基于肠道菌群失调所致的肠道微生态环境破坏,会导致宿主系统慢性炎症[23]。本研究VAD小鼠肠道炎症因子TNF-α和IL-6明显升高,提示VAD可导致不同种属肠道菌群在组成和数目上的分布差别,降低肠道抗定植能力,机体有益菌减少从而导致机会感染而致病。这也与VADN小鼠的肠道菌群丰度增加,伴随肠屏障功能改善结果相吻合。
综上所述,本研究发现VAD导致的小鼠肠道菌群失调会导致肠上皮黏膜通透性增强,促炎因子分泌增加,促进屏障功能损伤,这可能是VAD导致肠道损伤的机制之一。未来仍需进一步工作探究并阐明维生素A代谢与肠道菌群失调导致的肠道疾病发生发展的关系及背后调控机制,寻找基于维生素A水平参与的肠道功能保护靶点,为未来维生素A参与体内多器官生理功能维持提供新见解。
参考文献
[1] Who.Global prevalence of vitamin A deficiency in populations at risk 1995-2005[M].WHO Library Cataloguing in Publication,2009.
[2] O'Byrne SM,Blaner WS.Retinol and retinyl esters:biochemistry and physiology[J].J Lipid Res,2013,54(7):1731-1743.
[3] Harrison EH.Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids[J].Biochim Biophys Acta,2012,1821(1):70-77.
[4] O'Hara AM,Shanahan F.The gut flora as a forgotten organ[J].EMBO Rep,2006,7(7):688-693.
[5] 张发明.菌群重建治疗菌群失调相关性疾病的再认识[J].医学研究生学报,2019,32(12):1233-1236.
[6] 陈珊珊,何阳,张志华,等.肠道菌群对抑郁症的影响及其可能机制的研究进展[J].医学研究生学报,2020,33(10):1093-1097.
[7] Sittipo P,Lobionda S,Lee YK,et al.Intestinal microbiota and the immune system in metabolic diseases[J].J Microbiol,2018,56(3):154-162.
[8] Xiao L,Cui T,Liu S,et al.Vitamin A supplementation improves the intestinal mucosal barrier and facilitates the expression of tight junction proteins in rats with diarrhea[J].Nutrition,2019,57:97-108.
[9] Trasino SE,Benoit YD,Gudas LJ.Vitamin A deficiency causes hyperglycemia and loss of pancreatic beta-cell mass[J].J Biol Chem,2015,290(3):1456-1473.
[10] Diness BR,Christoffersen D,Pedersen UB,et al.The effect of high-dose vitamin A supplementation given with bacille Calmette-Guerin vaccine at birth on infant rotavirus infection and diarrhea:a randomized prospective study from Guinea-Bissau[J].J Infect Dis,2010,202 Suppl:S243-S251.
[11] Sommer A.Vitamin a deficiency and clinical disease:an historical overview[J].J Nutr,2008,138(10):1835-1839.
[12] Underwood BA.Vitamin A deficiency disorders:international efforts to control a preventable "pox"[J].J Nutr,2004,134(1):231S-236S.
[13] Etchamendy N,Enderlin V,Marighetto A,et al.Vitamin A deficiency and relational memory deficit in adult mice:relationships with changes in brain retinoid signalling[J].Behav Brain Res,2003,145(1-2):37-49.
[14] Das B,Nair GB.Homeostasis and dysbiosis of the gut microbiome in health and disease[J].J Biosci,2019,44(5).
[15] Wu GD,Chen J,Hoffmann C,et al.Linking long-term dietary patterns with gut microbial enterotypes[J].Science,2011,334(6052):105-108.
[16] Greenhill C.Gut microbiota:Firmicutes and Bacteroidetes involved in insulin resistance by mediating levels of glucagon-like peptide 1[J].Nat Rev Endocrinol,2015,11(5):254.
[17] Indiani C,Rizzardi KF,Castelo PM,et al.Childhood Obesity and Firmicutes/Bacteroidetes Ratio in the Gut Microbiota:A Systematic Review[J].Child Obes,2018,14(8):501-509.
[18] Shin NR,Whon TW,Bae JW.Proteobacteria:microbial signature of dysbiosis in gut microbiota[J].Trends Biotechnol,2015,33(9):496-503.
[19] Buschmann MM,Shen L,Rajapakse H,et al.Occludin OCEL-domain interactions are required for maintenance and regulation of the tight junction barrier to macromolecular flux[J].Mol Biol Cell,2013,24(19):3056-3068.
[20] Suzuki T.Regulation of the intestinal barrier by nutrients:The role of tight junctions[J].Anim Sci J,2020,91(1):e13357.
[21] Reifen R,Levy E,Berkovich Z,et al.Vitamin A exerts its antiinflammatory activities in colitis through preservation of mitochondrial activity[J].Nutrition,2015,31(11-12):1402-1407.
[22] Zaiger G,Nur T,Barshack I,et al.Vitamin A exerts its activity at the transcriptional level in the small intestine[J].Eur J Nutr,2004,43(5):259-266.
[23] Vijay-Kumar M,Aitken JD,Carvalho FA,et al.Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5[J].Science,2010,328(5975):228-231.


