血游离三碘甲状腺原氨酸水平可作为新型冠状病毒肺炎患者预后的预测指标
作者:文阅期刊网 来源:文阅编辑中心 日期:2022-03-09 09:02人气:
摘 要:目的:探讨非甲状腺疾病综合征(NTIS)对新型冠状病毒肺炎(COVID-19)患者的预后价值。方法:回顾性收集2020年1月14日-2月28日华中科技大学同济医学院附属同济医院收治确诊的COVID-19患者,根据游离三碘甲状腺原氨酸(FT3)值分为NTIS组(FT3<3.1 pmol/L)和非NTIS组。采用Logistic回归分析和Kaplan-Meier曲线分析NTIS与COVID-19预后的相关性。绘制受试者工作特征(ROC)曲线以确定FT3对住院死亡率的预测性能。结果:共纳入384例患者,其中NTIS组92例和非NTIS组292例,与非NTIS组比较,NTIS组炎症反应强烈,凝血功能障碍复杂,心脏损伤及全身其他器官损伤较多,但淋巴细胞绝对值、百分比较低。Logistic回归分析显示,NTIS与COVID-19严重程度(aOR=3.795)、急性呼吸窘迫综合征并发症(aOR=3.768)和急性心脏损伤并发症(aOR=3.698),以及住院死亡率(aOR=5.017)独立相关。Kaplan-Meier曲线显示NTIS组患者生存趋势较差,风险比为5.98。ROC曲线显示FT3预测轻症患者住院死亡率的临界值为3.395 pmol/L,重症/危重患者为3.035 pmol/L。结论:NTIS与COVID-19患者的不良预后相关。FT3值可作为COVID-19患者死亡率的预测指标。
关键词:严重急性呼吸综合征冠状病毒2 新型冠状病毒肺炎 非甲状腺疾病综合征 甲状腺激素 预后
The prognostic value of free triiodothyronine for COVID-19 patients
ZHAO Hui DANG Wen-pei ZOU Li-juan XIONG Jie LI Yong-sheng
Department of Intensive Care Unit, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology;
Abstract:Objective: To investigate the prognostic value of non-thyroid illness syndrome(NTIS) in patients with COVID-19. Methods: From January 14 to February 28, 2020, patients with confirmed critical COVID-19 in Tongji Hospital in Wuhan were retrospectively reviewed. Patients included were divided into two groups according to free triiodothyronine(FT3) values: the NTIS group(FT3<3.1 pmol/L) and the non-NTIS group. Logistic regression analysis and Kaplan-Meier curve were utilized to determine the association between NTIS and COVID-19. A ROC curve was plotted to determine the predictive performance of FT3 in in-hospital mortality. Results: A total of 92 and 292 COVID-19 patients respectively with and without NTIS were included. Compared to patients without NTIS, those with NTIS presented with robust inflammatory response, complex coagulation dysfunction, more cardiac injuries and other systemic injuries, but lower lymphocyte, lymphocyte percentage. Logistic regression revealed that NTIS was independently associated with severe/critical classification of COVID-19(aOR=3.795), unfavorable complications such as ARDS(aOR=3.768) and acute cardiac injury(aOR=3.698), death in hospital(aOR=5.017). The Kaplan-Meier survival curves suggested a trend of worse survival among patients with NTIS with a hazard ratio of 5.98. The ROC curve showed that the cut-off values of FT3 in predicting in-hospital mortality were 3.395 pmol/L for all patients and 3.035 pmol/L for severe/critical ones, respectively. Conclusion: NTIS is associated with poor prognosis in patients with COVID-19. The value of FT3 can be used as a predictor of mortality for COVID-19 patients.
Keyword:SARS-CoV-2; COVID-19; Non-thyroid illness syndrome; Thyroid hormone; Prognosis;
非甲状腺疾病综合征(non-thyroid illness syndrome, NTIS)发生于许多急性或慢性系统性疾病[1,2]。在疾病的急性期,甲状腺激素的变化可能与甲状腺激素转运改变、外周组织摄取甲状腺激素的能力以及D1/D3脱碘酶的表达活性有关。在慢性阶段,促甲状腺激素(thyroid-stimulating hormone, TSH)的降低是由于下丘脑促甲状腺激素释放激素(thyrotropin-releasing hormone, TRH)的表达受到抑制;因此,不同疾病过程下丘脑垂体甲状腺轴的激素变化不一[3]。最典型的甲状腺激素(thyroid hormones, TH)变化表现为低三碘甲状腺原氨酸(T3)、低或正常的甲状腺素(T4)和正常或轻度降低的TSH[4]。本文探讨NTIS对新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)患者预后的预测价值,从而促进COVID-19疾病风险分层管理,为临床治疗提供参考。
资料与方法
一般资料 回顾性收集华中科技大学同济医学院附属同济医院2020年1月14日-2月28日收治的新冠肺炎确诊患者的病历资料,并随访至2020年4月28日。纳入标准:①严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)阳性的COVID-19确诊成年病例;②入院3 d内具备甲状腺激素检查资料。排除标准:①住院时间<24h; ②孕、产妇;③有甲状腺相关疾病/手术或正在使用抗甲状腺药物/甲状腺激素替代治疗;④有自身免疫性疾病;⑤近6个月接受过放疗或化疗的患者。
数据收集 患者的临床资料来自医院的电子医疗和护理记录。收集以下数据:人口统计学数据、影像学表现、并存病、主要并发症、实验室指标、临床结局。实验室指标包括白细胞计数(WBC)、嗜中性粒细胞计数(N)、淋巴细胞计数(L)、淋巴细胞计数百分比(L%)、血小板计数(PLT)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、肌酐(Cr)、肾小球滤过率(estimated glomerular filtration rate, eGFR)、乳酸脱氢酶(LDH)、肌红蛋白(MYO)、超敏肌钙蛋白I(hs-cTnI)、N末端B型利钠肽原(NT-proBNP)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原降解产物(FDP)、D-二聚体(D-dimer)、降钙素原(PCT)、超敏C反应蛋白(hs-CRP)、铁蛋白;白介素(IL) -6 、IL-8、IL-10、肿瘤坏死因子α(TNF-α)。这些实验室指标在入院24h内抽血测定。并发症的定义如下: 急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)根据世界卫生组织COVID-19临时临床管理指南定义。当心脏损伤生物标志物肌酸激酶同工酶(CK-MB)和hs-cTNI水平高于参考区间上限或在心电图或超声心动图中发现新的异常时,即可诊断为急性心脏损伤[5]。高血压定义为收缩压 ≥140 mmHg 或舒张压 ≥90 mmHg 或使用抗高血压药物或有高血压病史,糖尿病定义为自我报告或使用口服降糖药或胰岛素或糖尿病病史[6]。
定义状态和分组 根据《新型冠状病毒肺炎诊疗方案(第八版)》将所有患者分为非重型、重型和危重型。NTIS的判定标准为无任何甲状腺疾病的甲状腺激素水平的改变,最典型的改变为T3低、T4低或正常,TSH正常或中度降低[1,3]。采用电化学发光法,使用罗氏Cobas e602电化学发光分析仪(德国罗氏)测量FT3、FT4、TSH值。正常参考值为:FT3(3.1~6.8 pmol/L)、FT4(12~22 pmol/L)、TSH(0.27~4.2 mIU/L)。根据FT3值将患者分为2组:NTIS组(FT3<3.1 pmol/L)和非NTIS组。
统计学分析 遵循正态分布的连续型变量以中位数(median)表示,不满足正态分布的以四分位数范围(IQR)表示,并使用曼-惠特尼秩和检验进行分析。分类型变量以计数(例)和百分数(%)记录,根据情况采用皮尔森卡方检验、连续性校正或Fisher精确检验进行分析。采用logistic回归分析,用粗比值比(crude odds ratio, cOR)和在校正年龄、脑血管疾病、慢性肾脏病、WBC、N、L、L%、PT、FDP、D-dimer、AST、ALB、LDH、eGFR、Cr、IL-6、IL-8、IL-10、TNF-α、hs-CRP、PCT、铁蛋白(ferritin)、hs-TNI、MYO、CK-MB、NT-proBNP后的调整比值比(adjusted odds ratio, aOR)评估效应量,探讨NTIS与疾病严重程度、不良并发症和结局之间的关系。绘制Kaplan-Meier生存图,并用 Log-rank 检验比较2组患者的生存差异,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,统计曲线下面积(area under curve, AUC)判断FT3对住院死亡率的预测价值。以P<0.05为差异有统计学意义。
结 果
实验室指标 共纳入384例COVID-19患者,其中男性197例(51%),女性187例(49%)。截至2020年4月28日,纳入的患者住院期间已死亡或出院存活。所有患者分为NTIS组和非NTIS组。2组FT3、FT4、WBC、N、L、L%、ALT、AST、LDH、eGFR、CREA、NT-proBNP、MYO、hs-cTnI、CK-MB、免疫炎症指标及凝血功能相关指标比较,差异均有统计学意义(P均<0.05),见表1。
疾病严重程度、并发症和临床结局 NTIS患者ARDS(41% vs 7%,P<0.001)和急性心脏损伤(29% vs 5%,P<0.001)的发生率显著高于非NTIS组,且死亡率显著高于非NTIS组(30% vs 6%,P<0.001)。Logistic回归分析表明,NTIS与COVID-19疾病严重程度(aOR=3.795,95%CI:1.074~13.414)、ARDS并发症(aOR=3.768,95%CI:1.160~12.242)、急性心肌损伤并发症(aOR=3.698,95%CI:1.192~11.471)、住院死亡率(aOR=5.017,95%CI:1.509~16.683)独立相关,见表2。KM曲线显示NTIS组比非NTIS组有更差的生存趋势,风险比(HR)为5.98 (95%CI:2.94~12.16)(Log-rank检验P<0.0001),见图1。
表1 2组患者临床特征及实验室指标比较
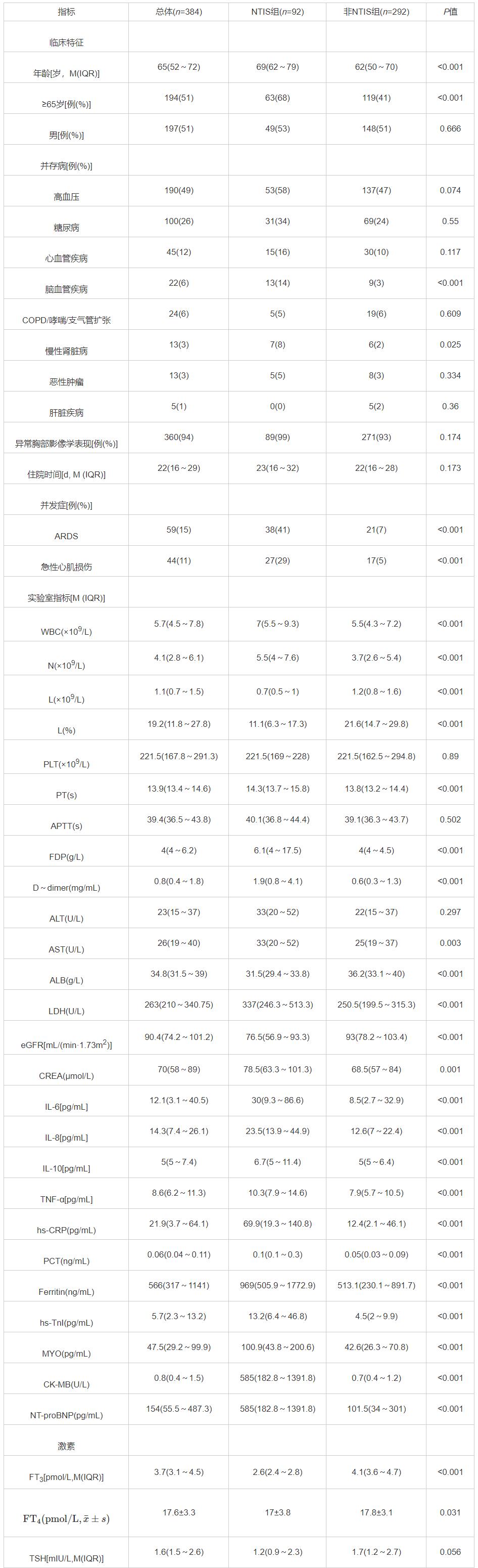
表2 疾病严重程度、并发症和临床结局的相关性分析[例(%)]
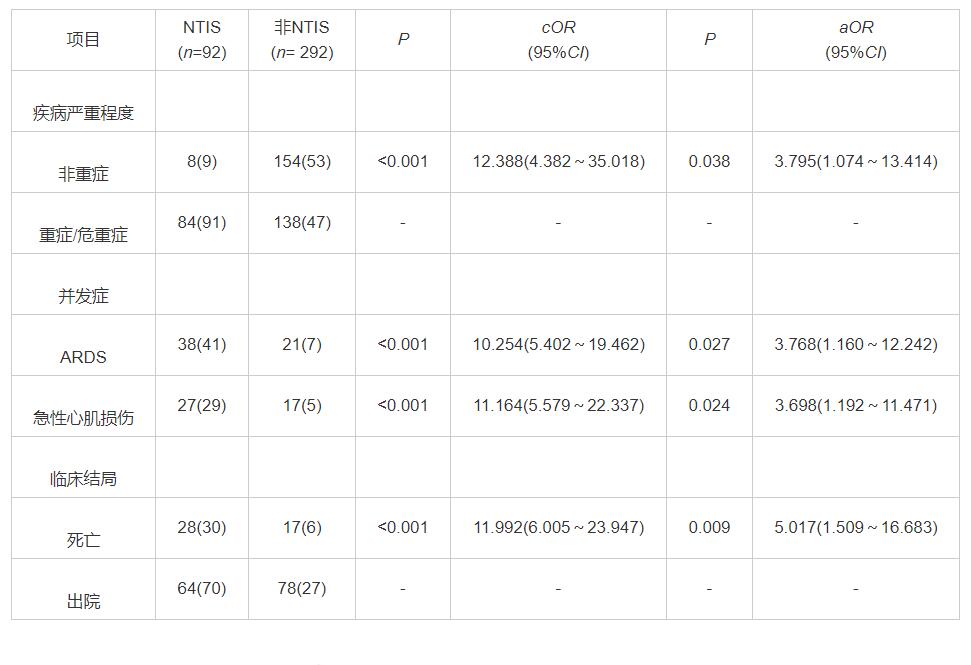
图1 NTIS组和非NTIS组的KM生存曲线比较
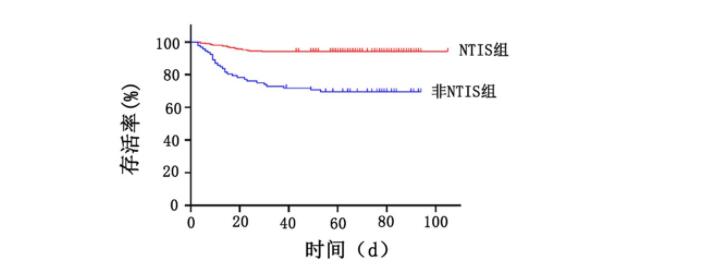
图2 ROC曲线预测患者死亡率
ROC曲线预测住院死亡率 对全体列入研究患者,FT3的最佳截断值为3.395 pmol/L,与住院死亡率相关,此时AUC为0.783,敏感性为0.800,特异性为0.693,见图2A。当剔除非重症患者后,截断值为3.035 pmol/L,此时AUC为0.699,敏感性为0.622,特异性为0.701,见图2B。这意味着对于重症患者而言,当FT3水平<3.035 pmol/L时,死亡风险高。
讨 论
SARS-CoV-2对甲状腺的影响越来越受到临床医生和学者的关注。在广义的生化层面上,COVID-19相关甲状腺功能障碍可概括为甲状腺毒症、甲状腺功能减退症和NTIS[1]。SARS-CoV-2对甲状腺的影响主要通过以下两个方面:一是病毒对下丘脑-垂体-甲状腺轴的直接攻击,二是宿主对病毒的免疫炎症反应[1]。
本文中NTIS组的WBC和N计数高于非NTIS组。D3脱碘酶被认为是一种主要的脱碘酶,可以灭活T3,已被证明当炎症发生时粒细胞中高表达,从而产生更多的I-,通过髓过氧化物酶系统发挥强大的杀菌能力[7]。NTIS组的L计数和L%明显低于非NTIS组。淋巴细胞减少可由病毒直接攻击和炎症因子介导的间接免疫损伤引起,病理学报告也显示甲状腺间质有淋巴细胞浸润[8]。其他实验室指标异常提示NTIS往往伴有强炎症反应、复杂的凝血功能障碍和心脏损伤等进行性系统性损害,从而预示更差的临床结局。在COVID-19重症病例中,细胞因子风暴被认为是疾病进展过程中的一个重要特征[9]。疾病过程中释放的细胞因子被认为是NTIS的重要决定因素,它们可以通过多个靶点抑制甲状腺激素的合成,包括钠/碘共转运体、甲状腺球蛋白、甲状腺过氧化物酶和D1脱碘酶[10]。NTIS与COVID-19的严重程度独立相关(aOR=3.795),与之前的研究一致[11]。NTIS在非重症患者中仅8例(8/162),重症和危重患者中达84例(84/222)。分析证实下丘脑垂体甲状腺轴的激素变化与病情恶化有关,在轻度疾病中,NTIS仅表现为FT3低。在严重或危重的疾病中,FT4和TSH也会由于TRH的下调而降低[10]。
本研究发现NTIS与COVID-19相关的ARDS (COVID-ARDS)独立相关(aOR=3.768)。ARDS的病理表现是由上皮细胞和内皮细胞损伤引起的上皮细胞通透性增加,肺泡液清除率降低导致肺泡水肿。有实验证实甲状腺激素通过增加肺泡II型细胞中Na+-K+-ATP酶的数量来改善肺泡液清除和减少纤维蛋白沉积[12,13]。表明甲状腺激素可以促进肺功能和肺损伤的修复,从而改善ARDS患者肺氧合,缩短呼吸机使用时间。目前,T3通过气管灌注治疗ARDS的I/II期临床试验正在开展,这将为ARDS的药物治疗提供更多可供选择的手段[14]。本研究表明NTIS与急性心脏损伤独立相关(aOR=3.698)。COVID-19并发症中,急性心脏损伤发生率排名第三,仅次于ARDS和I型呼吸衰竭。然而,病理报告却未见明显的心脏组织病理改变[15],这促使我们进一步探索心脏损伤的潜在机制。T3的心脏保护作用,如增强细胞耐受缺氧和促进组织修复,是通过缺氧和病毒感染激活的p38丝裂原活化蛋白激酶信号通路而实现的[16]。此外,甲状腺激素也可调节炎症免疫反应,从而抑制对心肌的有害影响[17]。在病理缺氧条件下,缺氧诱导因子1α促进D3脱碘酶基因转录的激活,从而降低血清T3水平[18]。有研究表明对心衰、心脏手术、急性心肌梗死等各种心血管疾病患者实施甲状腺激素替代治疗,可显著改善心功能和预后[17]。然而,甲状腺激素对特定疾病的治疗效果、普遍性和安全性仍需要未来进行大规模的临床试验来验证。
NTIS是COVID-19患者住院死亡率的一个重要预测指标。对于重症患者而言,FT3<3.035 pmol/L时存在较高的死亡风险。Guo等[19]在121名ICU住院患者中确定了12个预测住院死亡率的指标,其中FT3具有较高的预测能力,临界值为3.25 pmol/L。Gao等[20]发现100例重症患者的死亡率在FT3处于3.10~3.59 pmol/L范围开始上升,在2.60~3.09 pmol/L区间上升最多。
本研究有一些局限性。这是一项在单家医院的回顾性研究;且未观察甲状腺激素的动态变化;总T3、总T4、反向T3、甲状腺相关抗体及甲状腺B超未常规检查。回忆偏差可能存在;未监测下丘脑、垂体的功能和糖皮质激素的水平,未排除这些因素对内分泌腺的影响。
参考文献
[1] Scappaticcio L,Pitoia F,Esposito K,et al.Impact of COVID-19 on the thyroid gland:an update [J].Rev Endocr Metab Disord,2020,2020(25):1-13.
[2] 王晓会.急性心肌梗死患者经皮冠状动脉介入术中冠脉注射尼可地尔的临床评估 [J].内科急危重症杂志,2020,26(3):194-198.
[3] Van Den Berghe G.Non-thyroidal illness in the ICU:a syndrome with different faces [J].Thyroid,2014,24(10):1456-1465.
[4] Fliers E,Bianco AC,Langouche L,et al.Thyroid function in critically ill patients [J].Lancet Diabetes Endo,2015,3(10):816-825.
[5] Gao C,Wang Y,Gu X,et al.Association between cardiac injury and mortality in hospitalized patients infected with avian influenza A (H7N9) virus [J].Crit Care Med,2020,48(4):451-458.
[6] Genet B,Vidal JS,Cohen A,et al.COVID-19 In-hospital mortality and use of renin-angiotensin system blockers in geriatrics patients[J].J Am Med Dir Assoc,2020,21(11):1539-1545.
[7] Boelen A,Boorsma J,Kwakkel J,et al.Type 3 deiodinase is highly expressed in infiltrating neutrophilic granulocytes in response to acute bacterial infection [J].Thyroid,2008,18(10):1095-1103.
[8] 姚小红,李廷源,何志承等.新型冠状病毒肺炎(COVID-19)三例遗体多部位穿刺组织病理学研究[J].中华病理学杂志,2020,49(5):411-417.
[9] Lania A,Sandri M,Cellini M,et al.Thyrotoxicosis in patients with COVID-19:the thyrcov study [J].European journal of endocrinology,2020,183(4):381-387.
[10] De Vries EM,Fliers E,Boelen A.The molecular basis of the non-thyroidal illness syndrome[J].J Endocrinol,2015,225(3):R67-81.
[11] Zou R,Wu C,Zhang S,et al.Euthyroid sick syndrome in patients with COVID-19 [J].Front Endocrinol,2020,11,566439.
[12] Yu G,Tzouvelekis A,Wang R,et al.Thyroid hormone inhibits lung fibrosis in mice by improving epithelial mitochondrial function [J].Nat Med,2018,24(1):39-49.
[13] Lei J,Ingbra DH.Src kinase integrates PI3K/Akt and MAPK/ERK1/2 pathways in T3-induced Na-K-ATPase activity in adult rat alveolar cells [J].Am J Physiol Lung Cell Mol Physiol,2011,301(5):L765-771.
[14] Flory CM,Norris BJ,Larson NA,et al.A preclinical safety study of thyroid hormone instilled into the lungs of healthy rats-an investigational therapy for ARDS [J].J Pharmacol Exp Ther,2021,376(1):74-83.
[15] Xu Z,Shi L,Wang Y,et al.Pathological findings of COVID-19 associated with acute respiratory distress syndrome [J].The Lancet Respiratory Medicine,2020,8(4):420-422.
[16] Pantos C,Malliopoulou V,Paizis I,et al.Thyroid hormone and cardioprotection:study of p38 MAPK and JNKs during ischaemia and at reperfusion in isolated rat heart [J].Mol Cell Biochem,2003,242(1~2):173-180.
[17] Jabbar A,Pingitore A,Pearce SH,et al.Thyroid hormones and cardiovascular disease [J].Nat Rev Cardiol,2017,14(1):39-55.
[18] Simonides WS,Mulcahey MA,Redout EM,et al.Hypoxia-inducible factor induces local thyroid hormone inactivation during hypoxic-ischemic disease in rats [J].J Clin Invest,2008,118(3):975-983.
[19] Guo W,Ran LY,Zhu J H,et al.Identifying critically ill patients at risk of death from coronavirus disease [J].World J Emerg Med,2021,12(1):18-23.
[20] Gao W,Guo W,Guo Y,et al.Thyroid hormone concentrations in severely or critically ill patients with COVID-19 [J].J Endocrinol Invest,2020,44(5):1031-1040.
上一篇:运动对肥胖相关代谢异常的作用
下一篇:呼吸内科重症患者应急护理干预措施
下一篇:呼吸内科重症患者应急护理干预措施
热门排行


