褪黑素缓解糖皮质激素抑制MC3T3-E1细胞成骨分化与矿化的作用机制
作者:admin 来源:未知 日期:2021-03-29 09:13人气:
摘 要:
目的 褪黑素能否挽救糖皮质激素所导致的成骨分化障碍尚不明确。文中旨在探讨褪黑素对糖皮质激素所致成骨分化障碍的抑制作用。方法 应用地塞米松和褪黑素处理前成骨细胞系MC3T3-E1。将MC3T3-E1细胞分为对照组(基础培养液)、骨诱导组(骨分化细胞培养基)、地塞米松组(骨分化细胞培养基+100μmol/L地塞米松)、褪黑素组(骨分化细胞培养基+100μmol/L地塞米松+1μmol/L褪黑素);信号通路组(骨分化细胞培养基+100μmol/L地塞米松+1μmol/L褪黑素+1μmol/L LDN193189)与泛素化酶组(骨分化细胞培养基+100μmol/L地塞米松+1μmol/L褪黑素+5μmol/L MG132)。通过碱性磷酸酶(ALP)活性检测及染色、茜素红S染色及定量分析、qRT-PCR、Western blot评估细胞成骨分化和矿化。进一步分析BMP/Smad信号通路抑制剂(LDN193189)及泛素化酶抑制剂MG132对Runx2的影响。结果 MC3T3-E1细胞中ALP、OCN、COLL-1、Runx2 mRNA的表达水平比较,褪黑素组较地塞米松组明显升高(P<0.05),地塞米松组、对照组较骨诱导组明显降低(P<0.05)。与对照组、地塞米松组比较,骨诱导组可以显著提升ALP酶活性、茜素红染色定量表达、Runx2蛋白表达(P<0.05);与地塞米松组比较,褪黑素组显著增加了ALP酶活性、茜素红染色定量表达、Runx2蛋白含量(P<0.05)。与褪黑素组比较,信号通路组显著降低了Runx2蛋白含量(P<0.05),泛素化酶组Runx2蛋白含量表达亦显著降低(P<0.05),同时伴随着Smurf2表达显著增高(P<0.05)。结论 褪黑素通过BMP/Smad信号通路,缓解了地塞米松导致的MC3T3-E1细胞成骨分化的抑制,同时伴随着由Smurf2介导的泛素化途径参与。
关键词:
糖皮质激素 褪黑素 成骨分化 BMP/Smad信号通路 Smurf2
Melatonin rescues glucocorticoid-induced inhibition of osteoblast differentiation in MC3T3-E1 cells
ZHAO Rui ZHU Yue TAO Lin SHAN Jun
Minimally Invasive Orthopedic Surgery Ward, Shenyang Orthopedic Hospital; Department of Orthopaedics, the First Hospital of China Medical University;
Abstract:
Objective High-dose glucocorticoid(GC) administration causes osteoporosis. Melatonin participates in the regulation of osteoblast proliferation and differentiation, especially low concentrations of melatonin, which enhance osteoblast osteogenesis. This study aims to evaluate the role of melatonin in glucocorticoid-induced inhibition of osteoblast differentiation. Methods In this study, an examination of the expression of osteoblast differentiation markers(ALP, OCN, COLL-1, Runx2) as well as ALP staining and enzymatic activity assay, Alizarin red S staining and quantitation, qRT-PCR and Western blotting were performed to determine the effects of dexamethasone(Dex) and melatonin on the osteoblast differentiation of MC3 T3-E1 cells. The molecular mechanisms were explored by using BMP/Smad signalling inhibitors(LDN193189) and proteasome inhibitor MG132. Results We found that 100 μmol/L Dex significantly reduced osteoblast differentiation and mineralization in MC3 T3-E1 cells and that 1 μmol/L melatonin attenuated these inhibitory effects. We found that LDN193189 abolished melatonin-induced differentiation and mineralization. Meanwhile, MG132 significantly reduced the expression of Runx2, along with increased the expression of Smurf2 in melatonin-treated and Dex-induced MC3 T3-E1 cells. Conclusion These findings suggest that melatonin rescues Dex-induced inhibition of osteoblast differentiation and mineralization in MC3 T3-E1 cells via the BMP/Smad signalling pathway, along with the involvement of the ubiquitination mediated by Smurf2.
Keyword:
glucocorticoid; melatonin; osteoblast differentiation; BMP/Smad signalling; Smurf2;
0 引 言
糖皮质激素被广泛用作各种自身免疫和炎症疾病的抗炎和免疫抑制药物[1]。过量或长期应用糖皮质激素对骨骼造成若干不利影响,包括骨质疏松症[2]。研究表明,糖皮质激素抑制成骨细胞的生存和分化能力,这被认为是糖皮质激素诱发骨质流失过程中的一个重要机制[3]。而且,目前没有针对由糖皮质激素引起的骨质疏松症的特效治疗药物[2-4]。
褪黑素是一种从松果体中分离出来的胺类物质[5],已知能调节许多生物作用,包括昼夜节律[6]、调节睡眠[7],以及对免疫应答及抗氧化保护的作用等[8-10]。许多研究表明,褪黑素参与调节成骨细胞增殖和分化[11-14],特别是低浓度褪黑素被证实可以在体外和体内增强骨形成[15-18]。然而,褪黑素能否缓解糖皮质激素所导致的成骨分化障碍尚不明确。因此,本研究旨在探究褪黑素可否缓解地塞米松导致的小鼠前成骨细胞系MC3T3-E1细胞成骨分化障碍,并阐明相应的分子机制。
1 材料与方法
1.1 主要试剂与仪器
a-MEM培养基、胎牛血清、青/链霉素溶液、胰蛋白酶(以色列Bioind公司),DMSO、L-抗坏血酸、β-甘油磷酸钠、地塞米松、褪黑素、泛素化酶抑制剂MG132(美国Sigma公司),BMP/TGF-β/Smad信号通路抑制剂LDN193189 (中国上海碧云天生物技术有限公司),倒置显微镜(日本Nikon公司),超微量分光光度计(Nanodrop,美国Thermo公司),Roche Light Cycler© 480 II system qPCR仪器(瑞士Roche公司),PCR逆转录仪(美国Bio-Rad公司),酶标仪(美国BioTek公司),Western稳压稳流型电泳仪、Western电泳槽、ECL发光仪(美国Bio-Rad公司)。
1.2 细胞培养、细胞分组与成骨分化诱导
细胞系为小鼠前成骨细胞系MC3T3-E1细胞,从中国科学院细胞库购买。细胞培养于37 °C, 5% CO2环境下的细胞完全培养基中(a-MEM培养基∶血清∶双抗=100∶6∶1)。将MC3T3-E1细胞分别为对照组(基础培养液)、骨诱导组(骨分化细胞培养基)、地塞米松组(骨分化细胞培养基+100 μmol/L地塞米松)、褪黑素组(骨分化细胞培养基+100 μmol/L地塞米松+1 μmol/L褪黑素)、信号通路组(骨分化细胞培养基+100 μmol/L地塞米松+1 μmol/L 褪黑素+1 μmol/L LDN193189)与泛素化酶组(骨分化细胞培养基+100 μmol/L 地塞米松+1 μmol/L 褪黑素+5 μmol/L MG132)。当细胞融合度达到60%时,更换为骨分化细胞培养基(细胞完全培养基+50 mg/mL L-抗坏血酸+10 mmol/L β-甘油磷酸钠)进行分化诱导。根据实验要求培养7 d或28 d,每2~3天更换新鲜骨分化细胞培养基,可根据不同需要在骨分化细胞培养基加入不同浓度地塞米松、褪黑素、抑制剂等。
1.3 qRT-PCR法
根据miRNeasy RNA Mini Kit (Qiagen,USA)说明书提取细胞总RNA。根据GoScriptTM Reverse Transcription Mix, Oligo (dT) (Promega,USA)说明书将RNA逆转录为cDNA。按照GoTaq©qPCR Master Mix (Promega,USA)说明书要求,应用Roche Light Cycler© 480 II system (Roche,Switzerland)按照以下反应条件进行qRT-PCR,设置95 ℃ 2 min,1个循环,然后95 ℃ 15 s、60 ℃ 1 min,40个循环。GAPDH作为内参。应用程序自带软件计算结果。使用的引物序列如下,ALP基因正链5-3′ATCTTTGGTCTGGCTCCCATG,反链5′-3′TTTCCCGTTCACCGTCCAC;OCN基因正链5′-3′CTCCCATTGGCGAGTTTG,反链5′-3′TGTAGTCCAGGTGGAGCTTGTG;COLL-1基因正链5′-3′ACCTCCCAGTGGCGGTTATGAC,反链5′-3′AGTTCTTCTGAGGCACAGACGG;Runx2基因正链5′-3′TTTGCAGTGGGACCGACA,反链5′-3′AGCCATGGTGCCCGTTAG;GAPDH基因正链5′-3′AGAAAAACCTGCCAAATATGATGAC,反链5′-3′TGGGTGTCGCTGTTGAAGTC。
1.4 Western blot法
应用含1%蛋白酶抑制剂及1%磷酸酶抑制剂的蛋白裂解液提取细胞总蛋白,BCA法进行蛋白定量,将蛋白样品配平及变性,将蛋白样品按要求加入SDS-PAGE凝胶中,进行电泳,180 mA 70 min转膜,室温封闭1 h,去掉封闭液后,加入一抗4 ℃过夜孵育,TBST洗膜3次,加入二抗,室温孵育1 h,TBST洗膜3次后ECL发光仪显影曝光,用Image J软件计算条带灰度值,再用Graphpad Prism软件进行统计分析并制图。使用抗体如下anti-Runx2(#12556 rabbitmAb,Cell Signaling Technology Inc.); anti-Smad1(#6944 rabbit mAb, Cell Signaling Technology Inc.); anti-phospho-SMAD1/5/9(#13820 rabbit mAb, Cell Signaling Technology Inc.); anti-Smurf2(#sc-393848mousemAb, Santa CruzBiotechnology Inc.); anti-GAPDH(#60004-1-lg mouse mAb, Protein Tech Group Inc.); anti-Rabbit IgG(H+L)(#SA00001-2, Protein Tech Group Inc.); anti-Mouse IgG(H+L) (#SA00001-1, Protein Tech Group Inc.)
1.5 ALP活性检测
MC3T3-E1细胞根据需要分别用骨分化细胞培养基、地塞米松、褪黑素和不同种类的抑制剂处理7 d,应用无磷酸酶抑制剂的裂解液提取细胞内蛋白,然后根据ALP活性检测试剂盒(中国南京建成有限公司)的说明书进行检测。最后使用酶标仪在520 nm处测量碱性磷酸酶活性的吸光度。
1.6 ALP染色
MC3T3-E1细胞根据需要分别用骨分化细胞培养基、地塞米松、褪黑素和不同种类的抑制剂处理7 d,然后在室温下固定在4%的多聚甲醛中15 min,用PBS冲洗3次,并按照BCIP/NBT ALP染色试剂盒的制造商的说明书进行染色,用相机进行拍照保存。
1.7 茜素红S染色及定量
MC3T3-E1细胞根据需要处理28 d后,4%的多聚甲醛中固定15 min,用双蒸水冲洗后加入茜素红S染色液30 min。再次用双蒸水冲洗,用相机和显微镜进行拍照保存。加入10%氯化十六烷基吡啶一水(中国大连美仑有限公司)室温溶解1 h,使用酶标仪在562 nm处测量吸光度。
1.8 统计学分析
采用Graphpad Prism进行统计学数据分析。采用平均值±标准差(x¯±s)表示,组间均值比较采用t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 地塞米松对MC3T3-E1细胞中ALP、OCN、COLL-1 mRNA 表达的影响
与骨诱导组比较,地塞米松组100 μmol/L浓度时成骨分化相关基因(ALP、OCN、COLL-1)mRNA的表达水平明显降低(P<0.05),见表1。
2.2 褪黑素及地塞米松对ALP、OCN、COLL-1、Runx2 mRNA表达的影响
褪黑素组、骨诱导组MC3T3-E1细胞中ALP、OCN、COLL-1、Runx2 mRNA的表达水平较地塞米松组明显升高(P<0.05)。骨诱导组MC3T3-E1细胞中ALP、OCN、COLL-1、Runx2 mRNA的表达水平较对照组明显升高(P<0.05)。表明1 μmol/L褪黑素可以缓解地塞米松对MC3T3-E1细胞中ALP、OCN、COLL-1、Runx2 mRNA表达的抑制效应。见表2。
表 1 地塞米松对 MC3T3-E1 细胞中ALP、OCN、COLL-1 mRNA 的表达影响
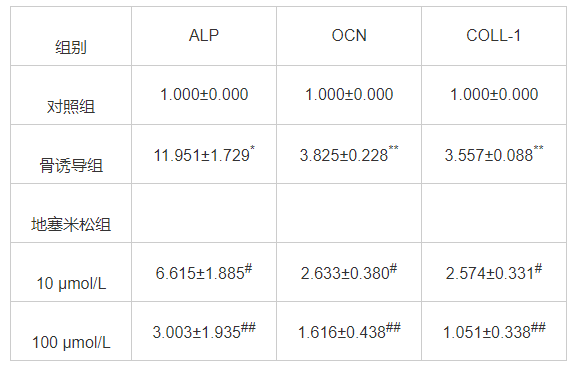
表 2 褪黑素及地塞米松对ALP、OCN、COLL-1、Runx2 mRNA表达的影响
2.3 褪黑素及地塞米松对ALP活性的影响
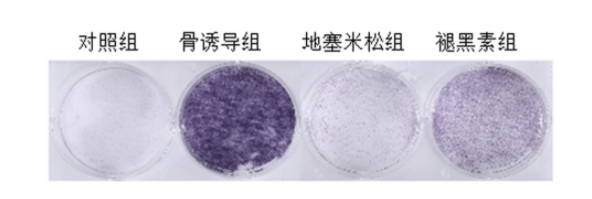
与对照组、地塞米松组比较,骨诱导组可以显著提升ALP酶活性;褪黑素组较地塞米松组显著增加了ALP酶活性。见图1。表明褪黑素可缓解地塞米松对ALP活性的抑制。
图 1 褪黑素可缓解地塞米松对ALP活性的抑制
2.4 褪黑素及地塞米松对细胞矿化能力影响
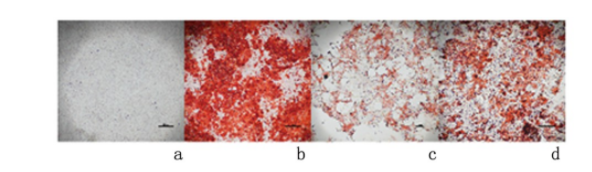
与对照组、地塞米松组比较,骨诱导组可以显著提高茜素红染色定量表达(P<0.01);褪黑素组较地塞米松组显著增加了茜素红染色定量表达(P<0.01)。见图2。表明褪黑素可缓解地塞米松对MC3T3-E1细胞矿化能力的抑制。
图 2 褪黑素可缓解地塞米松对细胞矿化能力的抑制

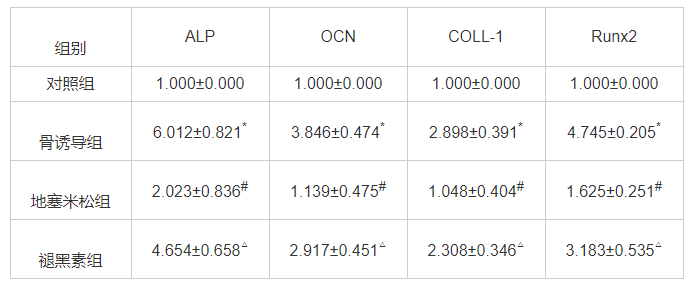
2.5 褪黑素及地塞米松对Runx2表达的影响
与对照组、地塞米松组比较,骨诱导组可以显著提升Runx2蛋白含量(P<0.05);与地塞米松组比较,褪黑素组显著增加了Runx2蛋白含量(P<0.05)。见图3。表明褪黑素可以缓解地塞米松对Runx2蛋白含量表达的抑制效果。
图 3 褪黑素可缓解地塞米松对Runx2表达的抑制

2.6 LDN193189及褪黑素对Runx2的缓解作用
与褪黑素组比较,信号通路组显著降低了Runx2蛋白含量(P<0.05),见图4,表明LDN193189能明显废除褪黑素对Runx2的缓解作用。
2.7 褪黑素对P-Smad1/5/9表达的影响
与地塞米松组比较,褪黑素组显著增加了P-Smad1/5/9蛋白含量(P<0.05),见图5,表明褪黑素可以增加P-Smad1/5/9的表达。
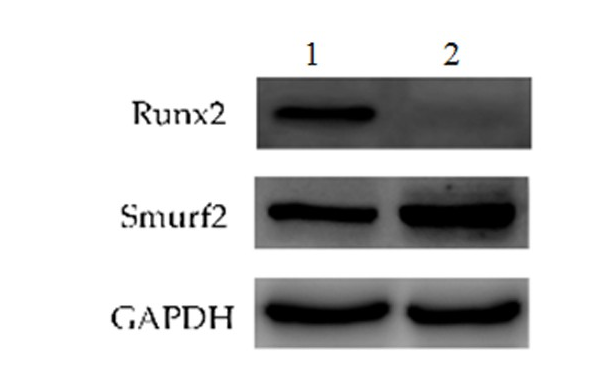
2.8 Smurf2及褪黑素对Runx2的缓解作用
泛素化酶组Runx2蛋白含量表达较褪黑素组显著降低(P<0.05),Smurf2表达显著增高(P<0.05)。见图6。表明MG132能明显废除褪黑素对 Runx2 的缓解作用,同时发现Runx2的降低伴随着Smurf2的升高。
图 4 LDN193189能明显废除褪黑素对Runx2的缓解作用
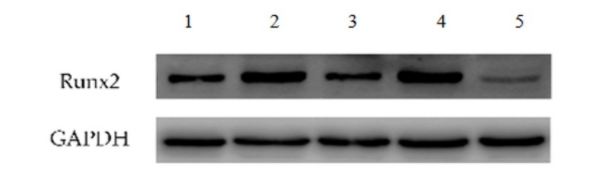
图 5 褪黑素可以增加P-Smad1/5/9的表达
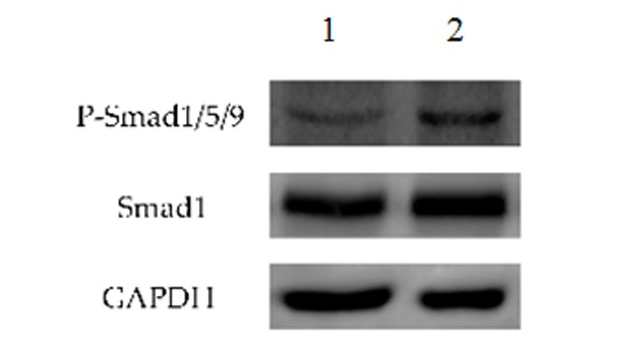
图 6 Smurf 2介导的泛素化途径参与褪黑素对Runx2的缓解作用
3 讨 论
糖皮质激素所致骨质疏松是常见的继发性骨质疏松。地塞米松(Dex)是人工合成的糖皮质激素之一,在临床治疗中使用广泛,但是长时间、大剂量应用对骨形成具有抑制作用。实验证实,高浓度的地塞米松(>107M)显著抑制了成骨细胞的成骨分化和矿化能力[3-4,19]。抑制成骨细胞增殖和分化被认为是糖皮质激素引起骨质疏松的关键因素[2,4]。在本次研究中,我们发现100 μmol/L地塞米松是对MC3T3-E1细胞成骨分化抑制性最强的浓度。然而,针对治疗糖皮质激素所致骨质疏松目前并没有特效的促骨生成药物,因此,迫切需要开发一种能有效治疗由糖皮质激素所致骨质疏松的药物。
有证据表明,褪黑素能增强骨髓间充质干细胞(BMSCs)以及前成骨细胞系MC3T3-E1细胞的增殖、分化和矿化的能力[17,20-22],这种效果通常伴随着Runx2 表达的增加[16,23-25]。Runx2是runt域家族的成员,在成骨细胞的分化和成熟中作为重要的转录因子起着至关重要的作用[26-27],并抑制BMSCs向脂肪细胞的分化[28],敲除Runx2基因小鼠显示出完全性骨生成障碍[29]。Runx2与成骨细胞中碱性磷酸酶(ALP)、骨钙素(OCN)、I型胶原蛋白(COLL-1)、骨脂蛋白(BSP)及骨桥蛋白(OPN)等主要成骨相关基因的表达密切相关[30-32]。
成骨细胞介导的骨生成与破骨细胞介导的骨吸收之间的平衡维持着骨的稳态[32]。众多信号通路参与成骨细胞分化的过程[33],其中BMP/Smads信号通路是激活成骨细胞分化及骨形成十分重要的一条通路[34-35]。多数学者认为BMPs对成骨细胞分化及骨形成具有特异性诱导作用[36]。BMP/Smad信号通路的激活通过磷酸化的Smad1/5/9诱导Runx2表达,然后Runx2诱导成骨细胞分化与成熟[25,34]。在此过程中,泛素蛋白酶体系统在BMP/Smads信号通路中发挥了重要调控作用,尤其是属于E3泛素连接酶的Smurf蛋白,Smurf1/2是 BMP/Smads信号通路负性调节因子,能特异性识别和结合Runx2及Smad1,促使它们经过泛素蛋白酶体途径降解,进而负向调节BMP/Smads信号通路,抑制成骨细胞分化及骨形成[16,37-38]。所以,我们在本次试验中着重检测了Runx2的表达,我们发现褪黑素对经过地塞米松处理的MC3T3-E1细胞分化和矿化能力具有缓解作用,而且褪黑素介导的对成骨细胞分化和矿化能力的缓解作用依赖于Runx2的表达增高。我们进一步使用BMP/Smad信号通路抑制剂发现BMP/Smad信号通路在褪黑素对地塞米松的缓解作用中占主导位置,并通过检测BMP/Smad信号通路关键蛋白P-Smad1/5/9的表达,证实了褪黑素激活了BMP/Smad信号通路,最后我们加入泛素化酶抑制剂MG132,我们发现MG132明显废除褪黑素对Runx2的缓解作用,并伴随着Smurf2升高,证实Smurf2介导的泛素化途径参与褪黑素对Runx2的缓解作用。
在本次实验中,我们发现了褪黑素可以缓解地塞米松对MC3T3-E1细胞分化和矿化的抑制作用,同时BMP/Smad信号通路为主导通路,而且这种调控作用依赖于Smurf2介导的泛素化途径。
参考文献
[1] Compston J.Management of glucocorticoid-induced osteoporosis[J].Nat Rev Rheumatol,2010,6(2):82-88.
[2] Migliaccio S,Brama M,Fornari R,et al.Glucocorticoid-induced osteoporosis:an osteoblastic disease[J].Aging Clin Exp Res,2007,19(3 Suppl):5-10.
[3] Yu W,Zhu C,Xu W,et al.Neuropeptide Y1 Receptor Regulates Glucocorticoid-Induced Inhibition of Osteoblast Differentiation in Murine MC3T3-E1 Cells via ERK Signaling[J].Int J Mol Sci,2016,17(12)
[4] Rauch A,Seitz S,Baschant U,et al.Glucocorticoids suppress bone formation by attenuating osteoblast differentiation via the monomeric glucocorticoid receptor[J].Cell Metab,2010,11(6):517-531.
[5] Lerner AB,Case JD,Mori W,et al.Melatonin in peripheral nerve[J].Nature,1959,183:1821.
[6] Hardeland R,Madrid JA,Tan DX,et al.Melatonin,the circadian multioscillator system and health:the need for detailed analyses of peripheral melatonin signaling[J].J Pineal Res,2012,52(2):139-166.
[7] Cardinali DP,Srinivasan V,Brzezinski A,et al.Melatonin and its analogs in insomnia and depression[J].J Pineal Res,2012,52(4):365-375.
[8] Paradies G,Petrosillo G,Paradies V,et al.Melatonin,cardiolipin and mitochondrial bioenergetics in health and disease[J].J Pineal Res,2010,48(4):297-310.
[9] Chahbouni M,Escames G,Venegas C,et al.Melatonin treatment normalizes plasma pro-inflammatory cytokines and nitrosative/oxidative stress in patients suffering from Duchenne muscular dystrophy[J].J Pineal Res,2010,48(3):282-289.
[10] Chahbouni M,López M,Molina-Carballo A,et al.Melatonin Treatment Reduces Oxidative Damage and Normalizes Plasma Pro-Inflammatory Cytokines in Patients Suffering from Charcot-Marie-Tooth Neuropathy:A Pilot Study in Three Children[J].Molecules,2017,22(10)
[11] Qiu S,Tao ZB,Tao L,et al.Melatonin induces mitochondrial apoptosis in osteoblasts by regulating the STIM1/cytosolic calcium elevation/ERK pathway[J].Life Sci,2020,248:117455.
[12] Tao L,Zhu Y.Melatonin regulates CRE-dependent gene transcription underlying osteoblast proliferation by activating Src and PKA in parallel[J].Am J Transl Res,2018,10(1):86-100.
[13] Meng X,Zhu Y,Tao L,et al.Overexpression of septin-7 inhibits melatonin-induced cell apoptosis in human fetal osteoblastic cells via suppression of endoplasmic reticulum stress[J].Mol Med Rep,2018,17(3):4817-4822.
[14] Meng X,Zhu Y,Tao L,et al.miR-590-3p mediates melatonin-induced cell apoptosis by targeting septin 7 in the human osteoblast cell line hFOB 1.19[J].Mol Med Rep,2018,17(5):7202-7208.
[15] Son JH,Cho YC,Sung IY,et al.Melatonin promotes osteoblast differentiation and mineralization of MC3T3-E1 cells under hypoxic conditions through activation of PKD/p38 pathways[J].J Pineal Res,2014,57(4):385-392.
[16] Lian C,Wu Z,Gao B,et al.Melatonin reversed tumor necrosis factor-alpha-inhibited osteogenesis of human mesenchymal stem cells by stabilizing SMAD1 protein[J].J Pineal Res,2016,61(3):317-327.
[17] Roth JA,Kim BG,Lin WL,et al.Melatonin promotes osteoblast differentiation and bone formation[J].J Biol Chem,1999,274(31):22041-22047.
[18] Xiong XC,Zhu Y,Ge R,et al.Effect of Melatonin on the Extracellular-Regulated Kinase Signal Pathway Activation and Human Osteoblastic Cell Line hFOB 1.19 Proliferation[J].Int J Mol Sci,2015,16(5):10337-10353.
[19] Xu S,Guo R,Li PZ,et al.Dexamethasone interferes with osteoblasts formation during osteogenesis through altering IGF-1-mediated angiogenesis[J].J Cell Physiol,2019,
[20] Park KH,Kang JW,Lee EM,et al.Melatonin promotes osteoblastic differentiation through the BMP/ERK/Wnt signaling pathways[J].J Pineal Res,2011,51(2):187-194.
[21] Radio NM,Doctor JS,Witt-Enderby PA.Melatonin enhances alkaline phosphatase activity in differentiating human adult mesenchymal stem cells grown in osteogenic medium via MT2 melatonin receptors and the MEK/ERK (1/2) signaling cascade[J].J Pineal Res,2006,40(4):332-342.
[22] Han Y,Kim YM,Kim HS,et al.Melatonin promotes osteoblast differentiation by regulating Osterix protein stability and expression[J].Sci Rep,2017,7(1):5716.
[23] Zhang L,Su P,Xu C,et al.Melatonin inhibits adipogenesis and enhances osteogenesis of human mesenchymal stem cells by suppressing PPARγ expression and enhancing Runx2 expression[J].J Pineal Res,2010,49(4):364-372.
[24] Sethi S,Radio NM,Kotlarczyk MP,et al.Determination of the minimal melatonin exposure required to induce osteoblast differentiation from human mesenchymal stem cells and these effects on downstream signaling pathways[J].J Pineal Res,2010,49(3):222-238.
[25] Choi YH,Kim YJ,Jeong HM,et al.Akt enhances Runx2 protein stability by regulating Smurf2 function during osteoblast differentiation[J].FEBS J,2014,281(16):3656-3666.
[26] Yamaguchi A,Komori T,Suda T.Regulation of osteoblast differentiation mediated by bone morphogenetic proteins,hedgehogs,and Cbfa1[J].Endocr Rev,2000,21(4):393-411.
[27] Komori T.Runx2,an inducer of osteoblast and chondrocyte differentiation[J].Histochem Cell Biol,2018,149(4):313-323.
[28] Komori T.Regulation of skeletal development by the Runx family of transcription factors[J].J Cell Biochem,2005,95(3):445-453.
[29] Komori T,Yagi H,Nomura S,et al.Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J].Cell,1997,89(5):755-764.
[30] Cheng A,Genever PG.SOX9 determines RUNX2 transactivity by directing intracellular degradation[J].J Bone Miner Res,2010,25(12):2680-2689.
[31] Stein GS,Lian JB,van Wijnen AJ,et al.Runx2 control of organization,assembly and activity of the regulatory machinery for skeletal gene expression[J].Oncogene,2004,23(24):4315-4329.
[32] Tsuchiya H,Kitoh H,Sugiura F,et al.Chondrogenesis enhanced by overexpression of sox9 gene in mouse bone marrow-derived mesenchymal stem cells[J].BiochemBiophys Res Commun,2003,301(2):338-343.
[33] Beederman M,Lamplot JD,Nan G,et al.BMP signaling in mesenchymal stem cell differentiation and bone formation[J].J Biomed Sci Eng,2013,6(8A):32-52.
[34] 庞新岗,包倪荣,赵建宁.长链非编码RNA调节成骨分化的研究进展[J].医学研究生学报,2017,30(11):1216-1221.
[35] 汪沛,曹志中.骨形态发生蛋白-9诱导牙周膜干细胞成骨分化及信号通路的研究进展[J].医学研究生学报,2015,28(12):1327-1332.
[36] Chen G,Deng C,Li YP.TGF-β and BMP signaling in osteoblast differentiation and bone formation[J].Int J Biol Sci,2012,8(2):272-288.
[37] Sun X,Xie Z,Ma Y,et al.TGF-β inhibits osteogenesis by upregulating the expression of ubiquitin ligase SMURF1 via MAPK-ERK signaling[J].J Cell Physiol,2018,233(1):596-606.
[38] Li J,Wang P,Xie Z,et al.TRAF4 positively regulates the osteogenic differentiation of mesenchymal stem cells by acting as an E3 ubiquitin ligase to degrade Smurf2[J].Cell Death Differ,2019,26(12):2652-2666.


